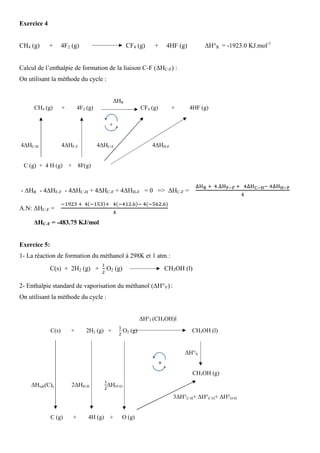
Le document présente des exercices de thermochimie, comprenant des calculs de constantes de gaz parfaits et d'enthalpies de réaction. Les méthodes de Hess et de la combinaison linéaire sont utilisées pour déterminer les enthalpies de diverses réactions, tout en abordant des sujets tels que la chaleur de vaporisation et les réactions de combustion. Enfin, des résultats spécifiques sont obtenus pour des substances telles que le méthanol et l'urée, avec des valeurs d'enthalpies de formation et des capacités calorifiques calculées.