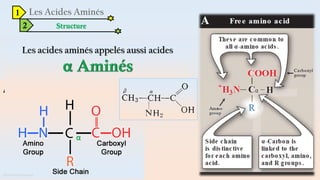
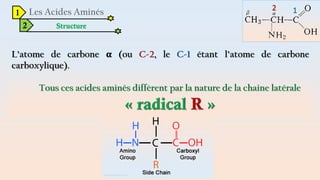
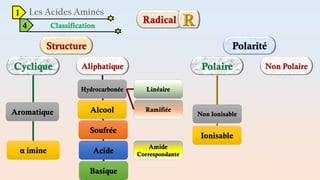
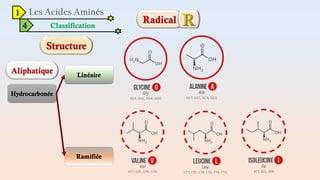
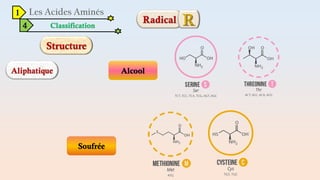
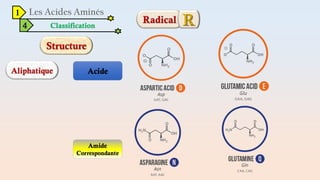
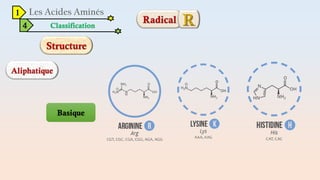
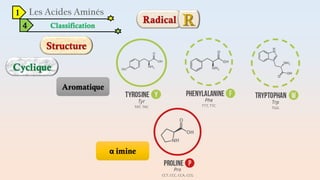
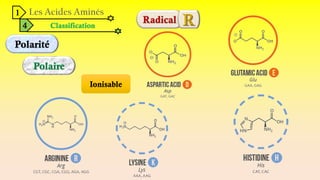
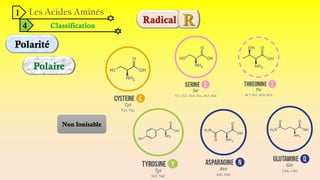
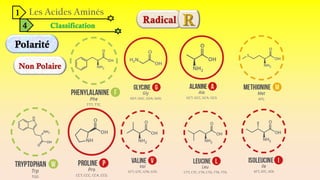
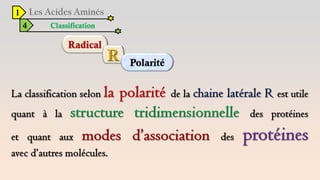
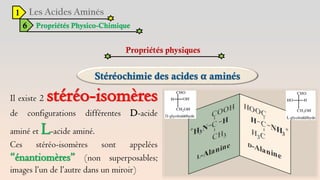
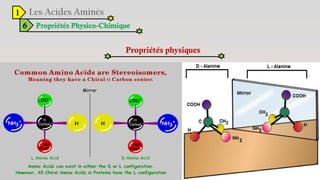
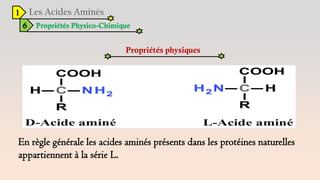
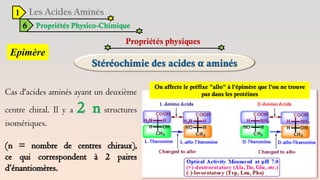
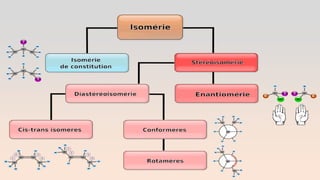
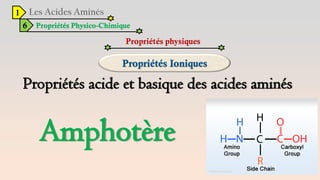
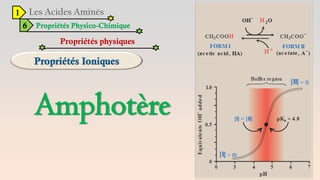
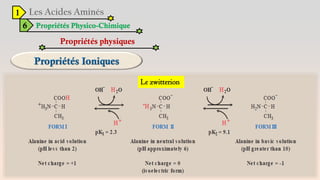
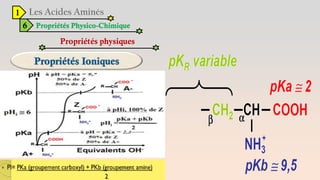
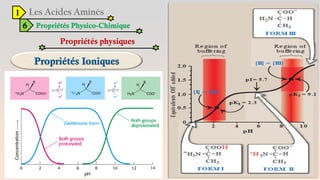
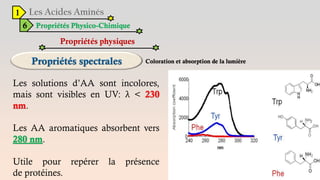
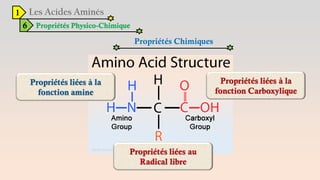
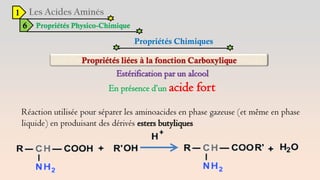
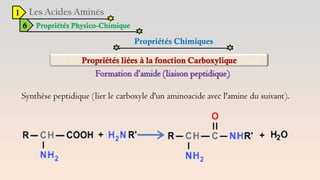
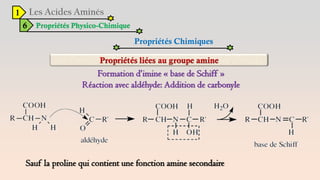
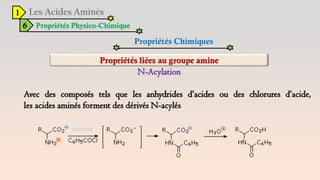
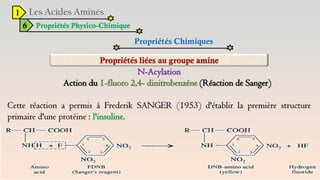
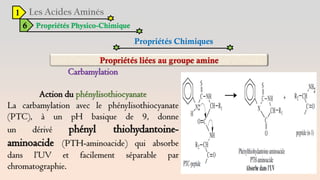
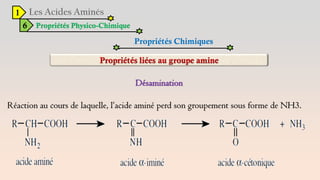
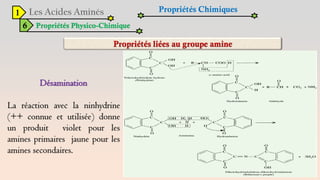
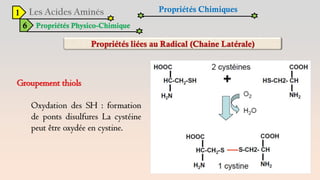
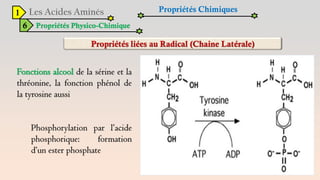
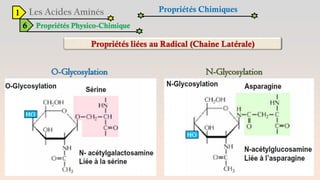
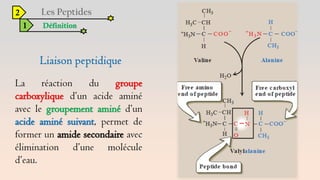
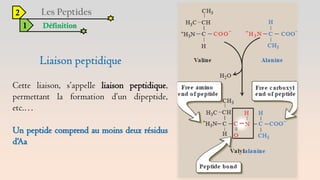
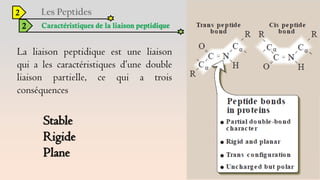
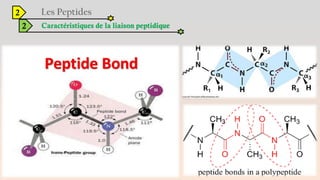
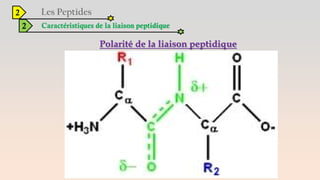
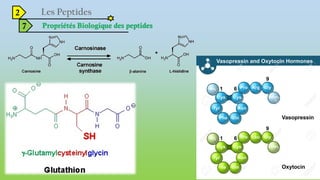
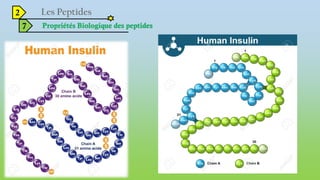
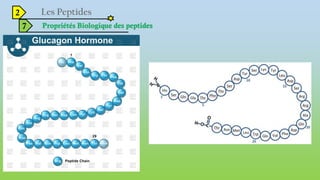
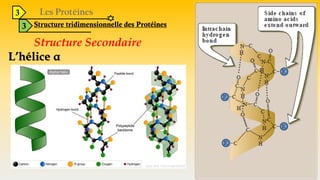
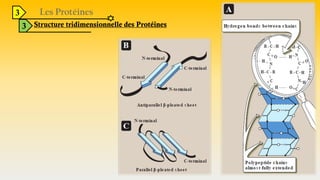
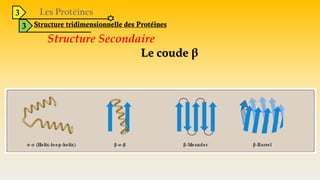
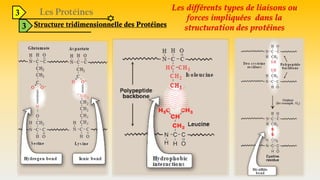
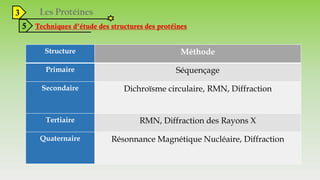
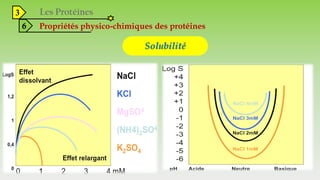
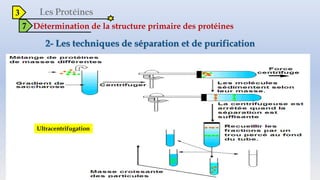
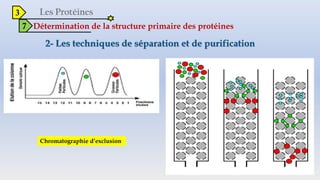
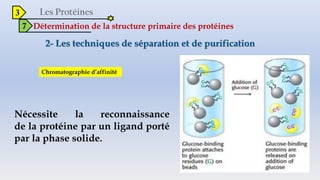
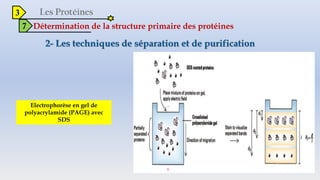
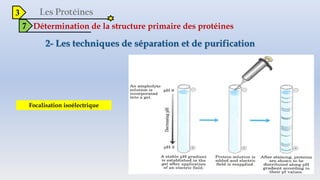
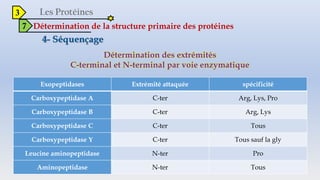
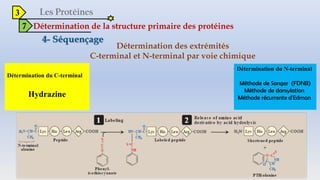
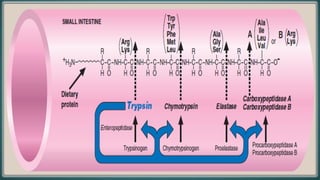
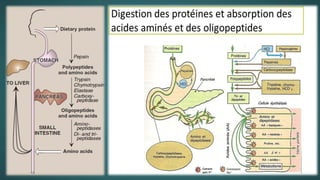
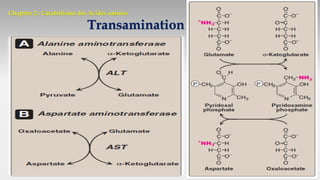
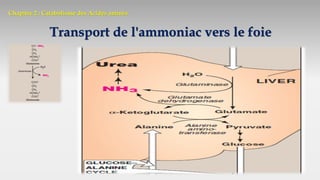
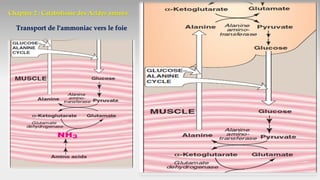
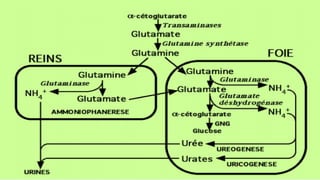
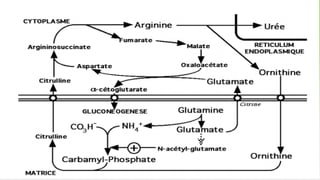
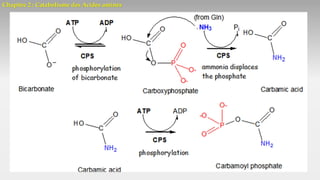
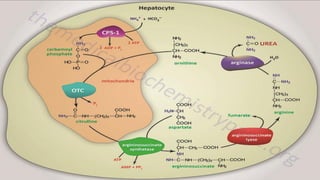
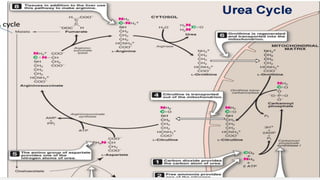
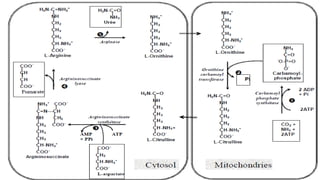
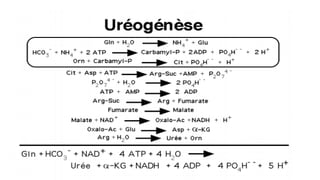
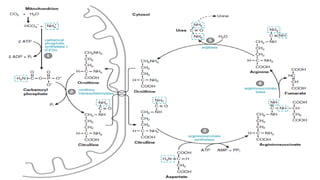
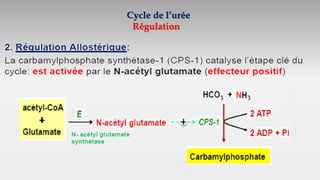
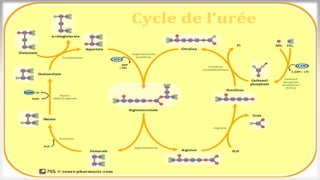
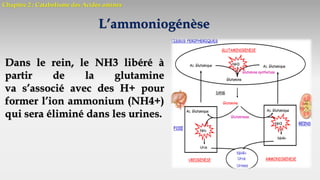
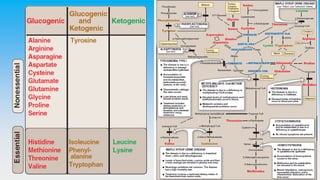
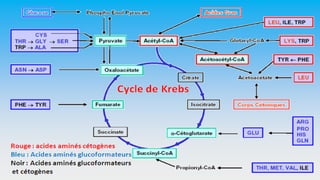
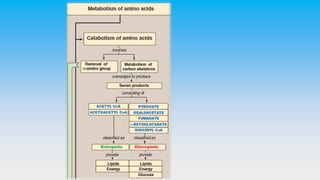
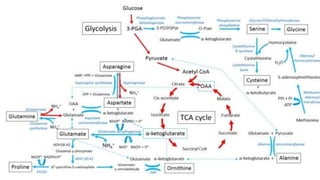
Le document est un exposé sur les protéines et les acides aminés, mettant en évidence leur diversité fonctionnelle et structurelle dans les systèmes vivants. Il aborde également les propriétés physico-chimiques des acides aminés, les réactions chimiques impliquant des peptides, et détaille la classification des protéines. Enfin, il décrit la structure tridimensionnelle des protéines ainsi que leur synthèse et leurs fonctions biologiques.