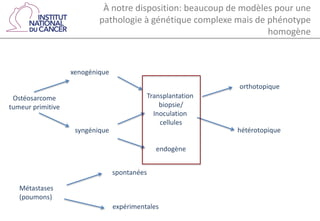
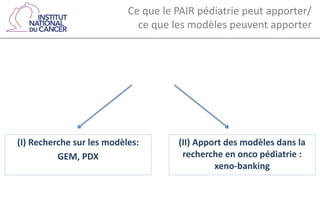
Le document traite d'un programme de recherche en cancérologie pédiatrique, mettant en avant l'importance des modèles animaux et organoïdes pour étudier cette maladie. Il identifie divers modèles précliniques, comme les xénogreffes et les modèles génétiquement modifiés, tout en soulignant les défis d'hétérogénéité des cancers et les limitations des méthodes actuelles. Enfin, il propose la création d'un consortium pour améliorer la recherche et le développement de traitements adaptés.