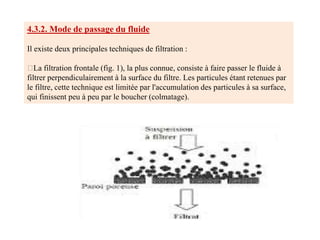
La centrifugation est une technique d'analyse utilisée pour séparer les composants d'un mélange en fonction de leur densité par l'application d'une force centrifuge. Elle peut se faire par différents types, comme la centrifugation différentielle, qui sépare les éléments selon leur taille ou masse, et la centrifugation en gradient de densité, qui utilise un milieu de séparation variable pour équilibrer les densités des particules. La précipitation des protéines est également abordée, impliquant des changements d'ions et de pH pour influencer la solubilité et provoquer l'agrégation des protéines.



































![4.2. Matériel (les filtres)
Il existe deux types de filtre : les filtres en profondeur ou d’épaisseur et filtres
membranes ou écran.
4.2.1. Les filtre en profondeur
Les filtre en profondeur sont constitués de substances fibreuses [papier
(cellulose, coton, fibre de verre, amiante) ou de substances agglomérées
(verre fritté, sable, charbon)]. Dans les deux cas, les particules qui doivent
être arrêtées par la filtration vont se bloquer dans un labyrinthe de canaux
existant à l’intérieur même du filtre.
L’efficacité d’un filtre en profondeur augmente donc avec son épaisseur, par
contre elle diminue lorsque la pression appliquée sur le filtre augmente.](https://image.slidesharecdn.com/coursthecniques1-231006095706-5baeeb22/85/cours-thecniques-1-pptx-36-320.jpg)