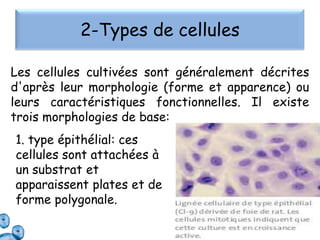
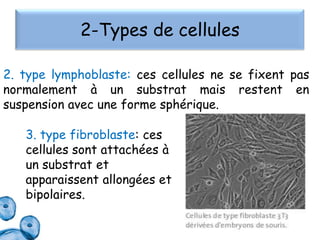
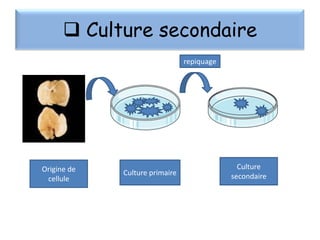
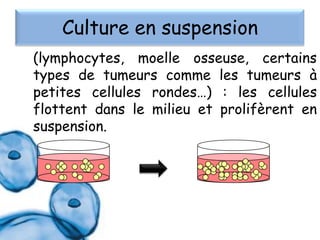
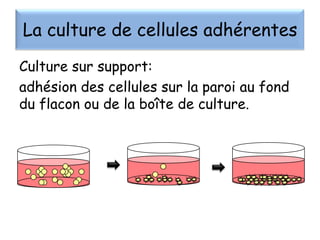
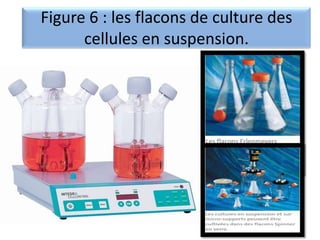
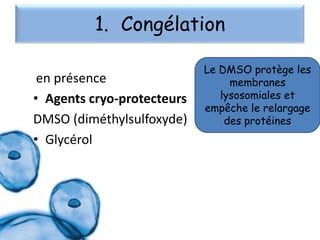
Le document présente un cours sur la culture cellulaire, incluant des techniques pour faire croître des cellules hors de leur organisme d'origine. Il couvre les types de cellules, les conditions de culture, et l'utilisation de cultures cellulaires dans la recherche et l'industrie pharmaceutique. Les avantages et inconvénients des cultures cellulaires, ainsi que les méthodes de conservation et les contaminants potentiels, sont également abordés.