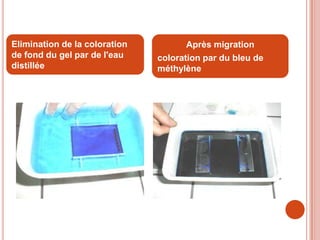
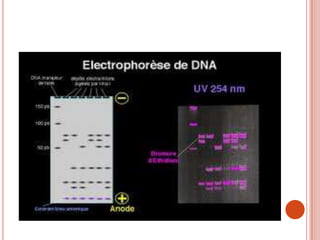
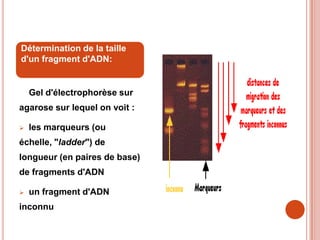
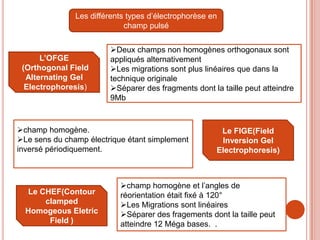
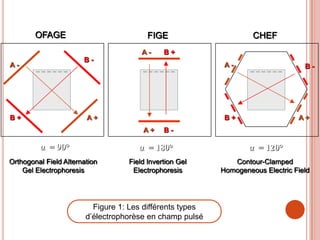
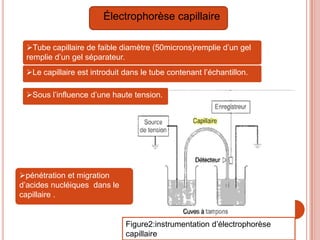
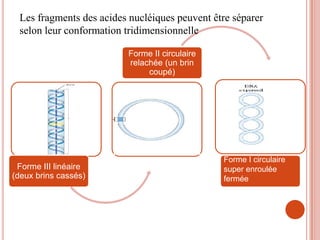
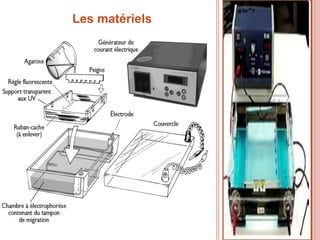
L'électrophorèse est une technique de séparation et d'analyse des molécules chargées par l'action d'un champ électrique, principalement utilisée en biochimie pour la séparation des acides nucléiques et des protéines. Les étapes incluent la préparation du gel d'agarose, le dépôt de l'ADN, et la révélation des fragments, avec différentes méthodes permettant d'analyser la taille des fragments d'ADN. Cette technique est essentielle dans des applications telles que la cartographie du génome, l'analyse de l'ADN et la détection de maladies génétiques.





![Principe
l'électrophorèse est basée sur le principe du
mouvement d’ions sous l’effet d’un champ
électrique.
La vitesse de migration des acides
nucléiques sera en fonction de :
les petits fragments
Taille
(PM ) Migrent rapidement [ ]du gel [ ]du gel
support
vitesse de
migration](https://image.slidesharecdn.com/lctrophorsedadn-120530044216-phpapp01/85/eLectrophorese-d-adn-7-320.jpg)


![Tampon d'électrophorèse
(tampon TBE). est une solution
contenant du Tris [tris (hydroxyméthyl)
aminométhane]
Du borate ,de EDTA (Ethyléne diamine
tétra acétate )ajustée à PH 8.3
Tampon de charge : bleu de
bromophénol - xylène cyanol - glycérol -
tampon TBE.](https://image.slidesharecdn.com/lctrophorsedadn-120530044216-phpapp01/85/eLectrophorese-d-adn-12-320.jpg)