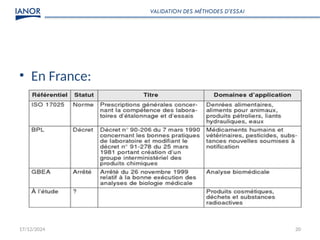
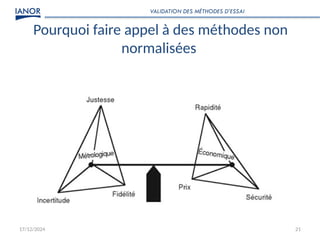
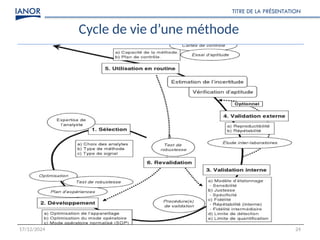
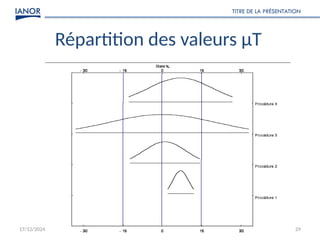
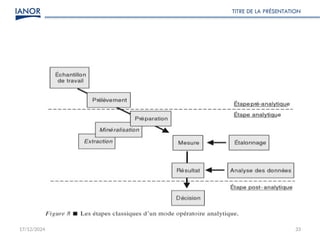
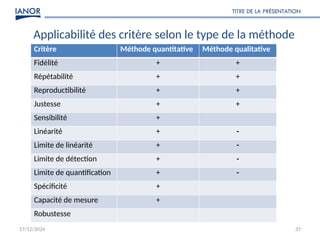
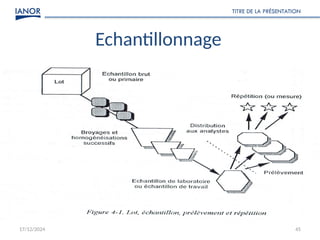
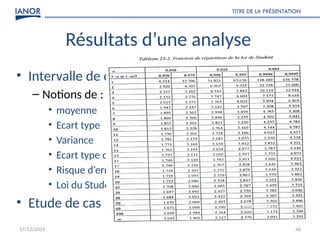
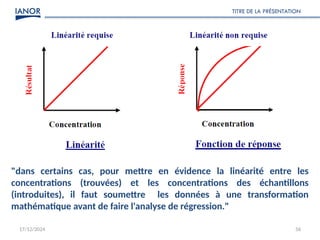
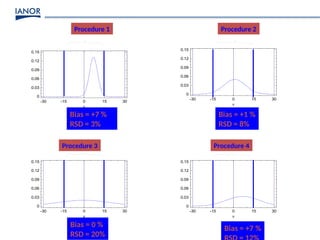
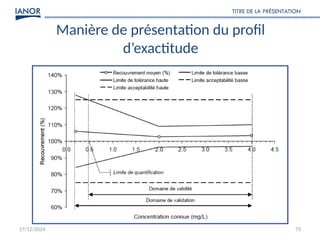
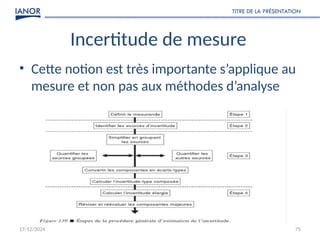
Le document présente une formation sur la validation des méthodes d'essai, conformément à la norme ISO/CEI 17025, afin de préparer les participants à élaborer des dossiers de validation et estimer les critères de performance des méthodes. Il détaille des concepts tels que la justesse, la fidélité, la limite de détection et l'optimisation des méthodes, tout en abordant des exigences normatives et la nécessité de valider les méthodes non normalisées. Enfin, il souligne l'importance de la documentation des procédures et de l'évaluation continue pour garantir la conformité aux attentes des clients.