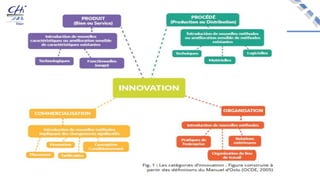
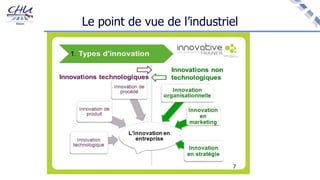
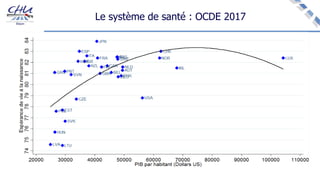
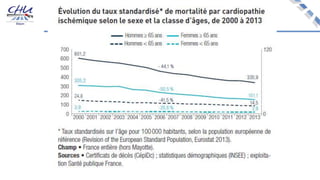
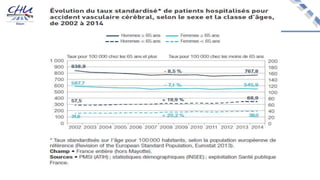
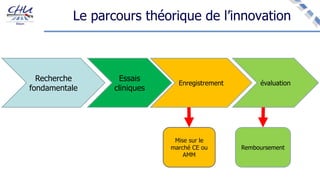
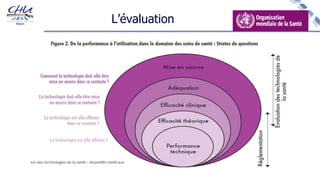
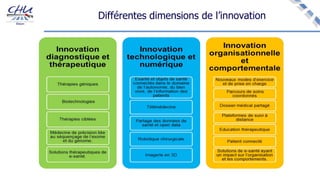
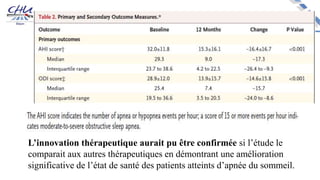
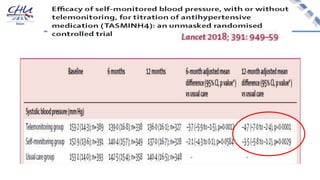
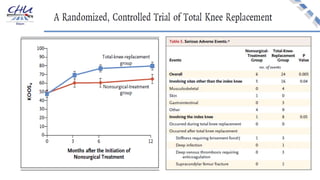
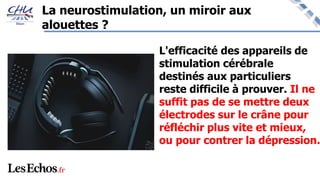
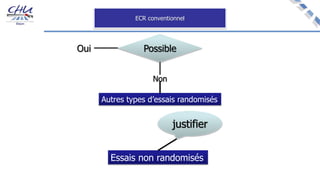
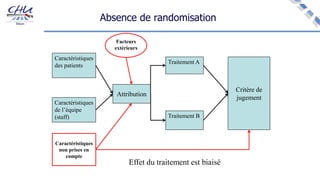
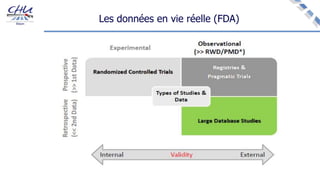
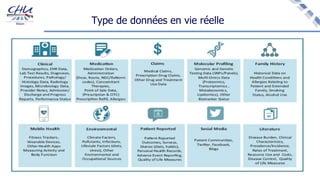
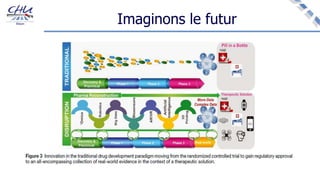
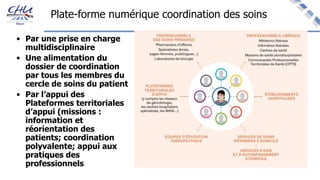
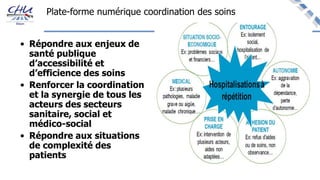
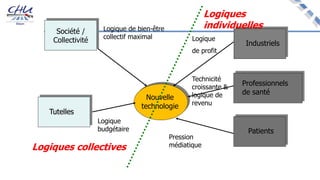
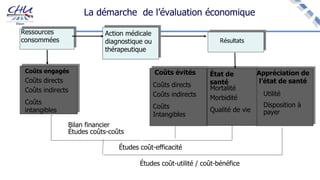
Le document aborde l'innovation en santé, en soulignant qu'il n'existe pas de définition unique et tant les perspectives des patients que celles des industriels et de la société influencent la perception de cette innovation. Il évoque également l'importance des études cliniques pour valider l'efficacité des nouvelles technologies et l'efficience économique des traitements. Enfin, il aborde les défis liés à la diffusion des innovations, l'évaluation médico-économique et la nécessité d'une approche coordonnée pour l'intégration des technologies de santé dans le système de soins.