Le document présente les items infectieux de l'ECN, développés par le Collège des universitaires de maladies infectieuses et tropicales, soulignant les messages clés et la cohérence avec l'ouvrage de référence e. pilly. Il rappelle l'importance de consulter les recommandations officielles récentes et le site www.infectiologie.com pour les mises à jour nécessaires. En outre, il est précisé que la version papier de l'ecn.pilly contient des informations supplémentaires par rapport à cette version électronique.






















































![50
Pilly - Préparation ECN - Item 83 - ©CMIT
Item 83
2-3. Évaluation de l’atteinte histologique hépatique (infections chroniques)
ƒƒ Directe : ponction biopsie hépatique (PBH) : score METAVIR précisant l’intensité de l’inflammation [A0-A4] et de la fibrose [F0-F4]).
ƒƒ Indirecte par scores biochimiques composites ou élastométrie impulsionnelle.
2-4. Imagerie
ƒƒ Échographie abdominale, voire TDM ou IRM hépatique si suspicion de nodules à l’échographie.
2-5. Fibroscopie œsophagienne
ƒƒ Recherche de varices œsophagiennes en cas de cirrhose.
3. Diagnostic différentiel
ƒƒ Autres hépatites virales (VIH, herpesvirus, arboviroses, fièvres hémorragiques)
ƒƒ Hépatites toxiques (alcooliques et autres), médicamenteuses.
ƒƒ Hépatites auto-immunes.
ƒƒ Autres hépatopathies chroniques :
-- cirrhose biliaire primitive
-- maladie de Wilson
-- hémochromatose.
II ARGUMENTER L’ATTITUDE THéRAPEUTIQUE ET PLANIFIER LE SUIVI DU PATIENT
1. Affirmer l’étiologie
2. Apprécier la gravité
3. Rechercher une évolution vers la chronicité, en cas d’hépatite B, C ou D
4. Surveillance régulière en cas d’hépatite chronique
ƒƒ Clinique, biologique, histologique, radiologie, endoscopique (Cf. bilan de gravité).
5. Poser les indications thérapeutiques
5-1. Généralités
ƒƒ Formes aiguës simples
-- Traitement symptomatique.
-- Si VHC, traitement si persistance PCR + ≥ 3 mois.
ƒƒ Formes fulminantes
-- Transfert en réanimation et traitement symptomatique.
-- Transplantation hépatique si insuffisance hépatique terminale.
ƒƒ Formes chroniques
-- Un traitement est indiqué :
• en cas de réplication documentée par PCR sérique
• dans les hépatites chroniques biologiquement et histologiquement actives
• ou en présence de critères prédictifs d’une forte probabilité de réponse au traitement.
• ou en présence de manifestations cliniques extra-hépatiques
• ou dans le but de réduire le risque de transmission (procréation).
ƒƒ Si cirrhose : surveillance clinique, biologique, histologique, radiologie, endoscopique tous les 6 mois. Transplantation hépatique si cirrhose sévère
(selon score pronostique de MELD, après inscription sur liste de transplantation).
5-2. Objectifs du traitement des formes chroniques
ƒƒ VHC = éradication virale.
ƒƒ VHB = 1) contrôler la réplication virale (contrôle virologique), 2) obtenir une séroconversion HBe (sauf mutant pré-core) voire idéalement HBs
(contrôle immunologique).
ƒƒ Dans tous les cas, normaliser les transaminases, faire régresser la fibrose, pour diminuer le risque d’évolution vers la cirrhose et le CHC.
5-3. Spécificités du traitement du VHB
5-3-1. Médicaments
ƒƒ Antiviraux : analogues nucléosidiques (lamivudine, telbivudine, entécavir) ou nucléotidiques (adéfovir, ténofovir) de la transcriptase inverse du VHB.
ƒƒ Interféron pégylé alpha 2a (Pégasys®
) à double visée immunomodulatrice et antivirale.
5-3-2. Indications, objectifs et schémas thérapeutiques
ƒƒ Indications : hépatites chroniques actives (≥ F2 et/ou ≥ A2) avec ADN VHB sérique +.
ƒƒ Objectifs :
-- virologique : réduire au maximum l'ADN VHB, déterminé par les techniques les plus sensibles (obtention de l’indétectabilité)](https://image.slidesharecdn.com/poly-malinf2012-150207030832-conversion-gate01/85/Poly-mal-inf-2012-57-320.jpg)





















































![Item 91
105
Pilly - Préparation ECN - Item 91 - ©CMIT
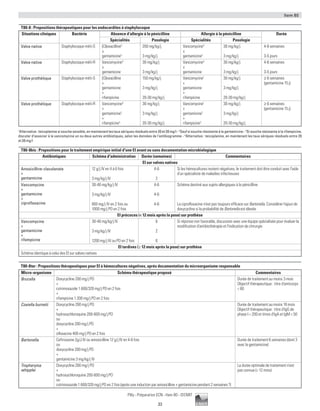
3-2. Précautions complémentaires
Précautions particulières à mettre en œuvre en complément des précautions standard en fonction du mode de transmission de l'infection
Précautions «air»
(lepatientémetdesparticulesinfectantes
[ 5 µm]quipersistentensuspensiondansl’air)
Précautions «gouttelettes»
(lepatientémetdesparticulesinfectantes[ 5 µm]
nepersistantpasensuspensiondansl’air)
Précautions «contact»
(seules les surfaces sont contaminées)
Lavage des mains Standard Standard Standard
Chambre individuelle + si possible en dépression + + (ou regroupement géographique des patients)
Masque, lunettes + (avant l’entrée dans la chambre) (FFP1, FFP2, FFP3) + (masque chirurgical) Standard
Gants Standard Standard Standard
Protection de la
tenue
Standard Standard Standard
Matériel et linge Standard Standard Standard
Transport du patient À encadrer À encadrer À encadrer
Exemple Tuberculose Méningocoque SARM
3-3. Isolement protecteur
ƒƒ Vise à protéger le patient immunodéprimé de toute contamination extérieure, afin d’éviter tout contact avec les microorganismes, y compris ceux
habituellement peu ou non pathogènes (Aspergillus).
ƒƒ Les mesures comprennent la réglementation de la circulation des personnes (personnels, patients et visiteurs), l'organisation architecturale
(chambres avec sas, éventuellement traitement de l'air, traitement de l'eau), l'utilisation de protections (blouses, gants, masques), l’utilisation éven-
tuelle de matériel de soins et d'une alimentation de qualité microbiologique adaptée.
III
SAVOIR EXPLIQUER ET APPLIQUER LES MESURES DE PRéVENTION DES INFECTIONS URINAIRES
NOSOCOMIALES
1. Introduction
1-1. Physiopathologie
Mécanisme ascendant prédominant.
Plusieurs possibilités pour la colonisation du bas appareil urinaire.
ƒƒ Acquisition lors de la mise en place de la sonde
La colonisation du méat est fréquemment incomplète après l’étape de désinfection, avec un risque très variable selon le terrain (en règle 1 % ; 20 %
chez la personne âgée hospitalisée).
ƒƒ Acquisition par voie endoluminale
Jadis dominante avec le “système ouvert” de Foley, elle est désormais très diminuée avec les “systèmes clos”, sauf en cas de faute d’asepsie.
ƒƒ Acquisition par voie extraluminale
Elle est prédominante avec les techniques actuelles de sondage avec système clos, les bactéries colonisant le méat pouvant migrer progressivement
vers l’urètre et la vessie par capillarité dans le fin film muqueux contigu à la surface externe de la sonde.
ƒƒ Acquisition par voie lymphatique ou hématogène
À partir d’une source endogène à distance. Ce mode est très rarement en cause.
1-2. Facteurs de risque
ƒƒ Extrinsèques, accessibles à la prévention
-- Sondage vésical.
-- Instrumentations (endoscopie, chirurgie urologique).
ƒƒ Intrinsèques, peu accessibles à la prévention.
2. Mesures de prévention des infections urinaires nosocomiales
ƒƒ Limiter l'indication des sondages et leur durée.
ƒƒ Respecter une technique aseptique de pose d’un système clos de drainage.
ƒƒ Respecter les règles d'entretien d'une sonde urinaire et d'un système de drainage clos.
ƒƒ Favoriser l’auto-sondage pluriquotidien pour les vessies neurologiques.
ƒƒ Mesurer le résidu mictionnel par échographie (“bladder scan”) plutôt que par sondage en aller-retour.
ƒƒ Préférer l’étui pénien au sondage (en fonction du résidu mictionnel).
ƒƒ Suivi épidémiologique et microbiologique pour détecter les phénomènes épidémiques.](https://image.slidesharecdn.com/poly-malinf2012-150207030832-conversion-gate01/85/Poly-mal-inf-2012-112-320.jpg)














![120
Pilly - Préparation ECN - Item 93 - ©CMIT
Item 93
ƒƒ Échographie des voies urinaires dans les 24 heures, dans le seul but d’exclure une forme compliquée méconnue par la clinique : lithiase, abcès rénal,
phlegmon périrénal… ; par contre une échographie normale n’exclut pas le diagnostic de PNA, les signes positifs («pyélite», lésion corticale) étant
inconstants. Attention ! Abdomen sans préparation (ASP) désormais non recommandé car de très faible ajout diagnostique alors qu'il expose aux
radiations ionisantes.
ƒƒ Antibiothérapie probabiliste par :
-- C3G injectables : ceftriaxone (IV/IM/SC) ou céfotaxime (IV/IM)
-- oufluoroquinolones(ciprofloxacine,lévofloxacine,ofloxacine)peros(IVsiimpossible)Attention!prudencesitraitementdansles6mois(cf.supra)
-- avec, si sepsis sévère, ajout initial d'un aminoside (gentamicine, nétilmicine, tobramycine) pendant 1 à 3 jours
-- si allergie : aztréonam ou monothérapie d'aminoside.
ƒƒ Traitement de relais par voie orale après obtention de l’antibiogramme :
-- amoxicilline
-- ou amoxicilline-acide clavulanique
-- ou céfixime
-- ou fluoroquinolones (ciprofloxacine, lévofloxacine, ofloxacine)
-- ou cotrimoxazole.
Durée totale d'antibiothérapie en cas d’évolution favorable : 10-14 j, sauf pour les fluoroquinolones : 7 j.
ƒƒ Traitement symptomatique : antalgiques ; antipyrétiques si fièvre mal tolérée.
ƒƒ Surveillance clinique.
ƒƒ ECBU de contrôle seulement si échec sous traitement ou récidive. Attention ! ECBU systématique désormais non recommandé du fait d'un risque
très faible d'échec pour les PNA non compliquées.
ƒƒ Si récidive, discuter une cystoscopie à distance pour recherche d'un reflux (découverte cependant rare à l'âge adulte), et avis urologique.
3-2. PNA compliquées = idem PNA non compliquées, sauf
ƒƒ Hospitalisation plus souvent nécessaire
ƒƒ Imagerie : préférentiellement tomodensitométrie rénale avec injection (uro-TDM) en urgence :
-- examen de choix pour explorer le parenchyme rénal et détecter une anomalie, mais exposant au produit de contraste (allergie, néphrotoxicité)
-- échographie des voies urinaires en cas de contre-indication à l'uro-TDM
-- Attention ! l'UIV n'a plus d'indication dans les PNA depuis l'utilisation de l'uro-TDM.
ƒƒ Bithérapie initiale [C3G injectables ou fluoroquinolone] + aminoside (schéma : Cf. supra) plus fréquemment indiquée (PNA sur obstacle, sepsis
grave…).
ƒƒ Durée totale d'antibiothérapie à moduler au cas par cas, souvent entre 10 et 14 j, parfois 21 j (abcès, BMR…). Attention ! L'antibiothérapie des PNA
compliquées peut être raccourcie à 10 à 14 j pour les formes les moins sévères.
ƒƒ En cas d'obstacle, drainage (instrumental ou chirurgical) en urgence.
ƒƒ ECBU de contrôle systématique (en per traitement [J2-J3] et post-traitement [4-6 semaines]) du fait du risque d'échec.
4. Devant une prostatite
ƒƒ Infection potentiellement grave :
-- de bon pronostic si le diagnostic est reconnu précocement et le traitement bien conduit
-- mais à risque de complications à type de sepsis grave, d’abcès prostatique, ou de passage à la chronicité, notamment chez le diabétique et l’im-
munodéprimé.
ƒƒ Antibiothérapie rendue difficile par la médiocre diffusion prostatique de nombreuses molécules (ß-lactamines, aminoglycosides…) surtout dans les
formes chroniques (fibrose…).
ƒƒ Stratégie diagnostique et thérapeutique variable selon la forme clinique.
4-1. Prostatites aiguës
ƒƒ Diagnostic microbiologique :
-- ECBU standard (mais quelques faux négatifs)
-- ECBU après massage prostatique déconseillé (douleur, risque de dissémination)
-- hémocultures dans les formes sévères.
ƒƒ Autres explorations :
-- Attention ! Dosage des PSA en phase aiguë non recommandé (élévation transitoire inconstante, ne représentant pas un critère diagnostique).
-- échographie des voies urinaires par voie sus-pubienne (recherche d'obstacle)
-- échographie transrectale systématique déconseillée (douleur, risque de dissémination)
-- en cas d'évolution défavorable, recherche d'abcès :
• idéalement par IRM
• à défaut par échographie transrectale.
-- À distance : bilan à la recherche d'un facteur favorisant (adénome, cancer) : échographie (prostate + arbre urinaire + recherche de résidu post-
mictionnel), dosage des PSA chez l'homme 50 ans (au minimum 6 mois après l'épisode).
ƒƒ Antibiothérapie :
-- Antibiothérapie probabiliste :
• C3G : ceftriaxone (IV/IM/SC) ou céfotaxime (IV/IM)](https://image.slidesharecdn.com/poly-malinf2012-150207030832-conversion-gate01/85/Poly-mal-inf-2012-127-320.jpg)














![135
Pilly - Préparation ECN - Item 96 - ©CMIT
Item n° 96 : Méningites infectieuses et méningo-encéphalites
chez l'enfant et chez l'adulte
OBJECTIFS TERMINAUX
II. Diagnostiquer une méningite infectieuse.
II. Identifier les situations d'urgence et planifier leur prise en charge.
III. Argumenter l'attitude thérapeutique et planifier le suivi du patient.
POUR COMPRENDRE
ƒƒ Méningite = inflammation des méninges
-- habituellement infectieuses (très rares méningites néoplasiques, inflammatoires [Behcet, sarcoïdose, lupus…], chimiques, médicamenteuses)
-- le plus souvent virales (entérovirus +++) et bénignes (sauf VIH, polio)
-- plus rarement bactériennes, de pronostic redoutable (mortalité, séquelles) mais amélioré par une prise en charge précoce optimale (antibiothé-
rapie, ± corticoïdes et réanimation)
-- exceptionnellement fongiques (cryptocoque chez l'immunodéprimé).
ƒƒ Méningo-encéphalite =
-- lésions cérébrales surajoutées (ou parfois isolées : encéphalites pures, sans méningite associée) pouvant être :
• infectieuses, dues à la multiplication microbienne
• post-infectieuse, d'origine immune, inflammatoire
-- responsables de symptômes (troubles de vigilance, signes de localisation…) à distinguer des complications neurologiques (empyème, abcès) des
méningites bactériennes graves
-- avec des étiologies particulières (HSV, Listeria, BK…) impliquant une conduite à tenir spécifique.
MéNINGITES INFECTIEUSES CHEZ L'ENFANT ET CHEZ L'ADULTE
i diagnostiquer une MéNINGITE INFECTIEUSE
1. Diagnostic positif
1-1. Facile cliniquement devant une forme typique
ƒƒ Début brutal.
ƒƒ Malaise général, fièvre, frissons.
ƒƒ Syndrome méningé : céphalées violentes + photophobie + vomissements + raideur méningée (raideur de nuque, signes de Kernig et de Brudzinski
inconstants).
ƒƒ Parfois purpura évoquant en premier lieu un méningocoque, a fortiori en cas de forme fulminante (les infections invasives à méningocoque peuvent
comporter soit un sepsis isolé avec ou sans purpura, soit une méningite, soit les deux combinés).
1-2. Parfois plus difficile
ƒƒ Forme en deux temps (notamment pour les infections invasives à méningocoque) avec tableau initial mimant une virose banale (fièvre, malaise, ±
rash)
ƒƒ Forme du nourrisson : fièvre ou hypothermie, troubles du comportement (agitation, somnolence), refus d'alimentation, fixité du regard, hypotonie
plutôt que raideur de nuque ; à un stade tardif convulsions et troubles de la conscience.
ƒƒ Formes frustes, atténuées par une antibiothérapie intercurrente.
ƒƒ Formes bâtardes : tableau psychiatrique, ou de pseudo AVC du sujet âgé…
1-3. Les examens complémentaires
1-3-1. Ponction lombaire (PL) à réaliser en urgence
ƒƒ Sauf si :
-- anomalie connue de l'hémostase
-- traitement anticoagulant efficace
-- suspicion clinique d'un trouble majeur de l'hémostase (= saignement actif)
-- instabilité hémodynamique
-- risque élevé d'engagement cérébral, à savoir :
• signes de localisation neurologiques
• troubles de vigilance (Glasgow ≤ 11)](https://image.slidesharecdn.com/poly-malinf2012-150207030832-conversion-gate01/85/Poly-mal-inf-2012-142-320.jpg)




















![156
Pilly - Préparation ECN - Item 100 - ©CMIT
Item 100
SAVOIR DIAGNOSTIQUER ET TRAITER UNE AMŒBOSE (AMIBIASE)
ƒƒ Agent causal : Entamoeba histolytica (protozoaire).
Il n’est pas possible à l’examen microscopique direct de différencier E. histolytica d’une autre amibe 9 fois plus fréquente et non pathogène : E. dispar.
ƒƒ Épidémiologie
-- Cosmopolite, elle est endémique dans les régions chaudes et humides.
-- Pathologie de retour des voyages.
ƒƒ Physiopathologie
-- Formes kystiques résistantes dans le milieu extérieur.
-- Transmission féco-orale par l’eau et les aliments ou manuportée.
-- Amœbose infestation (asymptomatique) : les formes végétatives (libérées par digestion des kystes ingérés) se multiplient dans la lumière digestive
et s’éliminent sous forme kystique.
-- Amœbose maladie : amœbose colique et amœbose tissulaire.
ƒƒ Les facteurs de passage de l’amœbose infestation à l’amœbose maladie sont mal connus.
ƒƒ Période d’incubation variable (quelques jours [amœbose colique] à quelques mois voire années [amœbose hépatique]).
ƒƒ Amœbose colique : invasion de la muqueuse colique donnant ulcérations et abcès “en bouton de chemise”.
ƒƒ Amœbose tissulaire, essentiellement hépatique : passage des amibes dans le flux veineux portal, arrêtées par le filtre hépatique ➞ nécrose hépato-
cytaire induisant la formation d’abcès ; possible extension pleuropulmonaire.
1. Diagnostiquer une amœbose colique (voir tableau)
1-1. Diagnostic clinique
ƒƒ Forme aiguë ou dysentérique.
ƒƒ Forme subaiguë la plus habituelle : selles molles, peu nombreuses ou simple «perte de la selle moulée quotidienne».
ƒƒ Pas de fièvre +++.
ƒƒ Complications rares : colite nécrosante, pseudo-tumeur de la fosse iliaque droite (amœbome).
1-2. Examens complémentaires
ƒƒ Examen parasitologique des selles (EPS ; 3 examens espacés de quelques jours ; émission au laboratoire car parasite fragile).
ƒƒ Sérologie très inconstamment positive et de peu d’intérêt dans cette forme.
ƒƒ Rectoscopie :
-- ulcérations en coup d’ongle
-- biopsie : abcès en bouton de chemise avec présence d’amibes.
ƒƒ Coloscopie, imagerie : devant une forme chronique, rebelle au traitement, pour éliminer une entéropathie inflammatoire, une néoplasie, une tubercu-
lose iléo-caecale,…
2. Argumenter l'attitude thérapeutique et planifier le suivi du patient
2-1.Amœbicides tissulaires
ƒƒ Métronidazole : 7 jours.
ƒƒ Inefficaces sur les formes kystiques (complément par amœbicide de contact).
2-2. Amœbicide de contact
ƒƒ Hydroxyquinoléine, 10 jours (non absorbé au niveau de l’intestin).
2-3. Indications
ƒƒ Amœbose infestation : amœbicide de contact.
ƒƒ Amœbose intestinale aiguë : métronidazole + hydroxyquinoléine.
ƒƒ Contrôle par EPS à distance du traitement.
3. Diagnostiquer une amœbose hépatique (voir tableau)
3-1. Diagnostic clinique : tableau d’hépatalgie fébrile
ƒƒ Fièvre.
ƒƒ Douleur de l’hypochondre droit, souvent irradiant à l’épaule droite, parfois toux sèche (irritation phrénique).
ƒƒ Parfois hépatomégalie.
3-2. Examens complémentaires d’orientation
ƒƒ Examens biologiques
-- hyperleucocytose à polynucléaires neutrophiles et élévation franche de la CRP.
ƒƒ Imagerie
-- radiographie du thorax : surélévation de la coupole droite ± comblement du cul-de-sac costo-diaphragmatique droit
-- échographie hépatique : aspect d’abcès unique ou multiples
-- tomodensitométrie : non indispensable quand l’échographie est contributive ; utile en cas d’abcès du dôme hépatique qui peuvent ne pas être
visible(s) en échographie.](https://image.slidesharecdn.com/poly-malinf2012-150207030832-conversion-gate01/85/Poly-mal-inf-2012-163-320.jpg)















![172
Pilly - Préparation ECN - Item 105 - ©CMIT
Item n° 105 : Surveillance des porteurs de valve et de prothèse
vasculaire
OBJECTIFS TERMINAUX
I. Expliquer les risques inhérents aux valves artificielles et aux prothèses vasculaires et les mesures préventives correspondantes.
II. Diagnostiquer une complication liée au matériel prothétique ou au traitement.
I
EXPLIQUER LES RISQUES INHéRENTS AUX VALVES ARTIFICIELLES ET AUX PROTHèSES VASCULAIRES
ET LES MESURES PRéVENTIVES CORRESPONDANTES
1. Nature des risques
1-1. Trois types de risque
Les risques des prothèses valvulaires et vasculaires et par extension des autres dispositifs cardiovasculaires (pace-maker [PM], défibrillateur…) sont
triples :
ƒƒ Risque de la pathologie sous-jacente traitée et du dispositif, avec des situations très diverses selon le degré de récupération apporté par le geste et
la nature du matériel. Se référer aux ouvrages de cardiologie.
ƒƒ Risque lié à l'éventuel traitement anticoagulant, avec là encore des situations très diverses entre l'abstention thérapeutique, le recours aux anti-
agrégants plaquettaires, ou la nécessité d'un traitement anticoagulant. Se référer aux ouvrages de cardiologie.
ƒƒ Risques infectieux. Seuls ces risques sont détaillés ci-après.
1-2. Risque infectieux
Au contraire des tissus natifs, les corps étrangers ne disposent d'aucun moyen de défense contre l'infection, et y sont au contraire très sensibles.
Chez les sujets porteurs de prothèse cardiovasculaire, les infections sont à la fois :
ƒƒ plus fréquentes, les matériaux favorisant l'adhésion des micro-organismes
ƒƒ plus sévères : exemple de l'endocardite infectieuse sur valve artificielle au pronostic aggravé (sur-incidence de micro-organismes virulents comme
Staphylococcus aureus ; surmortalité à micro-organisme identique)
ƒƒ d'expression clinique parfois différente, les micro-organismes pouvant rester quiescents au contact de la prothèse (protégés par le biofilm) des
semaines ou des mois après la contamination et s'exprimer tardivement
ƒƒ plus difficile à éradiquer : sur-incidence des bactéries multi-résistantes (BMR) nosocomiales ; difficultés thérapeutiques y compris pour les germes
très sensibles, le biofilm protégeant les micro-organismes de la phagocytose et de l'activité des anti-infectieux.
Aussi, quelle que soit la pathologie sous-jacente traitée, tout patient porteur d'une valve cardiaque devient un sujet à haut risque d'endocardite infec-
tieuse. Cette recommandation vaut quelle que soit la nature de la prothèse valvulaire (mécanique, bioprothèse ou homogreffe). En général, l'infection
se développe au contact de la prothèse (ou de la sonde endocavitaire de pace maker, de défibrillateur…) puis s'étend par contiguïté.
Tout sujet porteur d'une prothèse vasculaire est également à risque de “greffe infectieuse” à ce niveau, avec une évolution vers un anévrisme infec-
tieux, toujours à haut risque de fistule/rupture.
2. Mesures préventives correspondantes
La prévention doit s'envisager à la fois en amont de l'intervention, pendant la période péri-opératoire, et pour le reste de la vie.
2-1. Prévention en amont de l'intervention
Chaque fois que possible (c'est-à-dire pour tout geste réalisé “à froid”), il convient de :
ƒƒ Dépister et éradiquer tout foyer infectieux dentaire
-- Rationnel = les bactéries d'origine dentaire sont à haut risque de greffe
-- Dépistage par l'anamnèse (antécédent d'infections bucco-dentaires), l'examen (dentiste ou stomatologue), et la radiographie panoramique den-
taire systématique
-- Traitement non conservateur (avulsion) si risque de non-éradication de l'infection
-- Sans omettre l'antibioprophylaxie (Cf. Item 80) si le patient est déjà à haut risque d'endocardite.
ƒƒ Dépister et éradiquer un foyer infectieux d'un autre site
-- Rationnel = le réveil d'un foyer infectieux même ancien est à risque de “greffe” sur un matériel prothétique
-- Anamnèse pour rechercher les situations nécessitant d'éventuelles explorations complémentaires :
• ostéite chronique (antécédents traumatiques, fistule à la peau)
• fièvres “canalaires” (accès de fièvre + frissons marqués) urinaire ou biliaire.
-- Traitement éradicateur des éventuels foyers chaque fois que possible.
ƒƒ Dépister et traiter un portage de Staphylococcus aureus résistant à la méticilline (SARM)
-- Écouvillonnage nasal
-- Traitement des porteurs (mupirocine en application nasale + douche de chlorhexidine)
-- Dans le but de diminuer le risque d'infection péri-opératoire (médiastinite).](https://image.slidesharecdn.com/poly-malinf2012-150207030832-conversion-gate01/85/Poly-mal-inf-2012-179-320.jpg)


![175
Pilly - Préparation ECN - Item 106 - ©CMIT
Item n° 106 : Tuberculose
OBJECTIFS TERMINAUX
I. Diagnostiquer une tuberculose thoracique et connaître les localisations extra-thoraciques.
II. Argumenter l’attitude thérapeutique et planifier le suivi du patient.
INTRODUCTION
ƒƒ Tuberculose humaine : infection à mycobactéries (bacilles acido-alcoolo-résistants ou BAAR), à multiplication intra- et extracellulaire, croissance
lente et métabolisme aérobie strict, du complexe tuberculosis :
-- Mycobacterium tuberculosis (bacille de Koch [BK])
-- plus rarement Mycobacterium bovis et Mycobacterium africanum.
ƒƒ Troisième cause de mortalité par maladie infectieuse dans le monde, touchant surtout les populations en situation de précarité et/ou dans les pays
en développement :
-- incidence élevée en Afrique (surtout subsaharienne), Amérique latine, Asie, pays d’Europe Centrale et de l’Est
-- incidenceenFrance:8cas/100000(facteursderisque:infectionVIH,autreimmunodépression,précarité,provenanced’unpaysdeforteendémie).
ƒƒ Transmission interhumaine par voie aérienne à partir d’un patient excréteur de BK (d’autant plus si l’examen direct de l’expectoration ou des tubages
gastriques est positif et en cas de toux).
ƒƒ Primo-infection tuberculeuse (F106-1) :
-- pénétration du bacille par voie aérienne jusqu’au parenchyme pulmonaire
-- phagocytose par les macrophages qui se transforment en cellules épithélioïdes avec formation d’un granulome centré par de la nécrose caséeuse.
ƒƒ Avec destruction des mycobactéries, calcification du granulome = guérison (90 % des cas).
ƒƒ Ou persistance des mycobactéries se multipliant très lentement (quiescentes) = infection tuberculeuse latente (10 % des cas).
-- Réaction ganglionnaire satellite (complexe ganglio-pulmonaire de la primo-infection tuberculeuse)
ƒƒ Si infection tuberculeuse latente, risque d’évolution ultérieure vers la tuberculose maladie.
-- Incapacité du granulome à limiter la multiplication des mycobactéries
-- Multiplication bactérienne se développant dans les espaces alvéolaires, ou dans les macrophages infectés avec diffusion aux ganglions régionaux
-- Puis par voie lymphatique ou hématogène vers les tissus (apex pulmonaire, reins, corps vertébraux, épiphyse des os longs, méninges).
F106-1 : Histoire naturelle simplifiée de la tuberculose humaine
Miliaire, tuberculose
extrapulmonaire
Tuberculose pulmonaire
commune
Sujet contagieux
Sujet contaminé
Primo-infection tuberculeuse
Voie aérienne
90 %
Voie hématogène/lymphatique Voie bronchogène
10 %
Guérison Infection tuberculeuse
latente
Tuberculose maladie
- Soit précoce 2 ans
- Soit réactivation tardive](https://image.slidesharecdn.com/poly-malinf2012-150207030832-conversion-gate01/85/Poly-mal-inf-2012-182-320.jpg)







![Item 107
183
Pilly - Préparation ECN - Item 107 - ©CMIT
Le plus souvent, elle survient dans la 1re
semaine du séjour et guérit spontanément en 3 à 5 jours. Elle est d’origine bactérienne dans plus de la moitié
des cas (Escherichia coli entéropathogène, notamment entérotoxinogène [ETEC], Campylobacter jejuni, Salmonella enterica sérotype non-Typhi, Shi-
gella,..), virale dans 5 à 25 % des cas et parasitaire (protozoaires) dans moins de 10 % des cas.
En règle, l’antibioprophylaxie n’est pas recommandée.
En revanche, il faut expliquer au sujet les modalités du traitement :
ƒƒ réhydratation dans tous les cas : sachets de réhydratation orale pour les enfants +++
ƒƒ antisécrétoires et/ou ralentisseurs du transit : lopéramide contre-indiqué avant 30 mois et en cas de diarrhée invasive, ou racécadotril
ƒƒ antibiotique si diarrhée invasive ou si diarrhée cholériforme persistant au-delà de 24 à 48 heures. Les molécules à privilégier sont les fluoroqui-
nolones ou l’azithromycine (hors AMM). La durée du traitement varie de 1 jour (diarrhée cholériforme, non fébrile) à 5 jours (diarrhée aiguë fébrile
T ≥ 38,5 °C, avec dysenterie).
3-2. Prévention du paludisme
Elle est basée sur
La protection contre les piqûres d’anophèle (répulsif cutané et vêtements longs imprégnés ; moustiquaires imprégnées).
La chimioprophylaxie
Voir Chapitre Paludisme
3-3. Vaccinations
Le programme vaccinal du voyageur doit tenir compte de plusieurs paramètres :
ƒƒ évaluation des risques réels encourus par le voyageur, qui varient selon :
-- contexte épidémiologique international
-- situation sanitaire et conditions d’hygiène du pays de destination
-- conditions, durée et période de séjour
-- âge, grossesse, antécédents médicaux
-- statut immunitaire
-- statut vaccinal antérieur.
ƒƒ Obligation administrative de vaccination pour entrer dans certains pays
ƒƒ Enfin, le budget est un paramètre décisionnel important puisque les vaccins du voyageur ne sont pas pris en charge par la Sécurité sociale.
En pratique, doivent être envisagés les vaccins de «routine», les vaccins obligatoires et les vaccins recommandés (“Règle des 3R” : “Routine, Required,
Recommended”).
3-3-1. Vaccins de “routine”
ƒƒ Le voyage est l’occasion de mettre à jour le calendrier vaccinal, notamment pour les vaccins diphtérie - tétanos - poliomyélite ; éventuellement,
coqueluche, rougeole et hépatite B.
ƒƒ Chez l’enfant non encore vacciné, le BCG, le vaccin rougeoleux (dès l’âge de 6 mois, avec un vaccin monovalent) et le vaccin hépatite B sont vivement
recommandés en cas de séjour prolongé ( 1 mois) dans un pays de forte endémie.
ƒƒ Le vaccin grippal est indiqué chez tous les voyageurs de plus de 65 ans, chez les sujets à risque et chez les personnels navigants et guides accompa-
gnant les groupes de voyageurs. Toutefois, le vaccin adapté à l’hémisphère Sud n’est à ce jour disponible que sur ATU nominative.
3-3-2. Vaccins obligatoires
ƒƒ Le vaccin amaril (fièvre jaune) est un vaccin vivant atténué, obligatoire — si non obligatoire : indispensable — pour l’Afrique intertropicale et la
région amazonienne (voir F107-2). Il est efficace (en cas de primo-vaccination) 10 jours après l’injection et pour une durée de 10 ans. Le vaccin amaril
est possible dès 9 mois, (de 6 à 9 mois si risque d’exposition élevé), déconseillé pendant la grossesse (sauf si le séjour en zone endémique ne peut
être reporté) et contre-indiqué en cas d’immunodépression. Chez les patients infectés par le VIH, il est réalisable si le taux de lymphocytes CD4 est
supérieur à 200 par mm3
. Chez les plus de 60 ans, bien évaluer le rapport bénéfice - risque en raison de la survenue possible (rare) de complications
post-vaccinales sévères en cas de primovaccination.
ƒƒ Le vaccin méningococcique tétravalent (A,C,Y,W135) est un vaccin (polysaccharidique ou conjugué) obligatoire pour les pèlerinages à La Mecque.
ƒƒ Ces vaccins obligatoires doivent être authentifiés par un médecin d’un Centre agréé de Vaccinations Internationales, sur un carnet de vaccinations
internationales.](https://image.slidesharecdn.com/poly-malinf2012-150207030832-conversion-gate01/85/Poly-mal-inf-2012-190-320.jpg)














![199
Pilly - Préparation ECN - Item 202 - ©CMIT
Item n° 202 : Exposition accidentelle au risque de transmission
virale VIH, VHB et/ou VHC (AEV) (conduite a tenir)
OBJECTIFS TERMINAUX
I. Décrire la prise en charge immédiate d’une personne victime d’un AEV.
POUR MIEUX COMPRENDRE
Un accident d’exposition au risque de transmission virale VIH, VHB et/ou VHC (AEV) concerne toute personne exposée à un risque dans un cadre
professionnel (AES : piqûre avec une aiguille, coupure avec un objet tranchant, projection sur une plaie, une peau lésée ou une muqueuse...) ou non
(relation sexuelle, pratique d’injection de drogue…).
1. Risque de transmission
1-1. Accident d’Exposition au Sang (AES)
ƒƒ VIH : le taux de séroconversion après exposition percutanée au sang d’un patient infecté est estimé à 0,3 %.
Une prophylaxie par un traitement antirétroviral réduit ce risque sans le supprimer.
ƒƒ VHC : le taux de transmission après exposition percutanée se situe entre 1 et 3 %.
ƒƒ VHB : le taux de transmission après exposition percutanée chez un sujet non vacciné peut atteindre 30 % (patient source AgHBs+ et virémique).
La vaccination obligatoire chez les professionnels est l’élément majeur de prévention.
1-2. Accident d’Exposition Sexuelle
ƒƒ VIH : le taux de séroconversion est estimé aux alentours de 1 % après un rapport anal réceptif entre hommes, de 0,1 % après un rapport vaginal.
L’infectiositéestliéeauniveauderéplicationvirale,majoréeparlesISTassociées,lesmenstruationsoutoutsaignementaucoursdesrapportssexuels.
ƒƒ VHB : le taux de séroconversion est aux alentours de 50 %.
ƒƒ VHC : le risque est significatif en cas de relation sexuelle traumatique (saignement, viol...).
i
PRISE EN CHARGE IMMéDIATE D’UNE PERSONNE VICTIME D’ACCIDENT D’EXPOSITION AU SANG (AES) :
ACCUEIL DE LA VICTIME ET RECUEIL D’INFORMATIONS
1. Soins immédiats : nettoyage de la plaie
ƒƒ Blessure ou piqûre : nettoyage immédiat à l'eau courante et au savon (l’effet recherché est une détersion, et l’élimination des matières organiques
apportées par l’accident (sang), ne pas utiliser un produit hydro-alcoolique), rinçage, antisepsie (5 minutes au moins) : Javel à 2,5 % de chlore actif
diluée au 1/5 ou au 1/10, dakin, ou à défaut alcool à 70°, polyvidone iodée.
ƒƒ Projection muqueuse (conjonctive...) : rinçage immédiat abondant au sérum physiologique (5 minutes au moins).
2. Il s’agit généralement d’un accident du travail
ƒƒ Déclaration d’accident de travail obligatoire dans les 48 heures.
ƒƒ Rédaction d’un certificat médical initial décrivant la blessure et notifiant expressément qu’il s’agit d’un accident avec risque de séroconversion VIH
nécessitant un suivi sérologique prolongé de 3 mois.
3. Recherche du statut sérologique du patient source
ƒƒ Sérologie VIH, et en cas de positivité : charge virale VIH, dernier génotype connu (notion de résistance à certains antirétroviraux ?).
ƒƒ Sérologie VHC, et en cas de positivité recherche de réplication virale (ARN VHC).
ƒƒ Si la victime n’est pas immunisée contre l’hépatite B (l’immunité post-vaccinale est prouvée par un titre d’anticorps HBs 100 U/l ou 10 U/l avec
recherche d’antigène HBs négative), recherche d’Ag HBs chez le patient source et, en cas de positivité, recherche de réplication virale (ADN VHB).
ƒƒ Si le statut sérologique du patient source n’est pas connu, et après son accord (hors situation où le patient source est dans l’impossibilité de répondre
àunepropositiondetest[coma…]),ilfautréaliserenurgencelessérologiesVIH,VHCetéventuellementVHB;pourleVIH,préconiserl’utilisationdes
tests de diagnostic rapide dont les résultats sont disponibles en moins d’une heure.
4. Risque VIH : traitement antirétroviral post-exposition (TPE)
4-1. Décision de mise en route d’un TPE
ƒƒ En urgence, au mieux ≤ 4 h suivant l’accident, au plus tard jusqu’à 48 heures.
ƒƒ Par le médecin référent VIH préférentiellement.
ƒƒ À défaut, par le médecin des urgences (après éventuel avis téléphonique du médecin référent).
ƒƒ Au-delà de la 48e
heure après l’exposition, la mise en route d’un TPE semble sans intérêt (expose inutilement à un risque de iatrogénie).](https://image.slidesharecdn.com/poly-malinf2012-150207030832-conversion-gate01/85/Poly-mal-inf-2012-207-320.jpg)

















![Item 291
217
Pilly - Préparation ECN - Item 291 - ©CMIT
ƒƒ des examens d’imagerie
ƒƒ une analyse directe de l’adénopathie :
-- cytoponction à l’aiguille fine : peu invasif (réalisé au lit du patient) mais faible sensibilité. Examen cyto-bactériologique direct + cultures sur milieux
appropriés (bactériologie, mycobactéries, champignons) ± PCR
-- biopsie (radioguidée ou chirurgicale), voire exérèse chirurgicale. Le ganglion doit être divisé stérilement, lors du geste, en fragments pour analyse
bactériologique (standard + mycobactéries), mycologique et histologique, en avertissant les laboratoires et en transportant les prélèvements dans
les conditions appropriées. En cas de polyadénopathie, il est préférable d’éviter de biopsier les adénopathies axillaires ou inguinales, car la biopsie
est plus risquée et l’apport diagnostique étiologique moins rentable.
i
DEVANT UNE ADéNOPATHIE SUPERFICIELLE, ARGUMENTER LES PRINCIPALES HYPOTHèSES
DIAGNOSTIQUES ET JUSTIFIER LES EXAMENS COMPLéMENTAIRES PERTINENTS
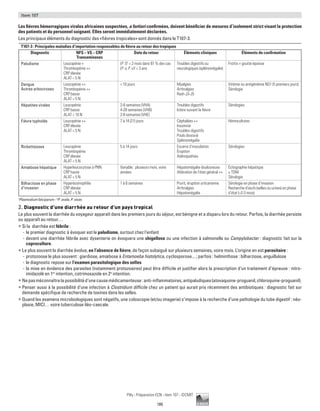
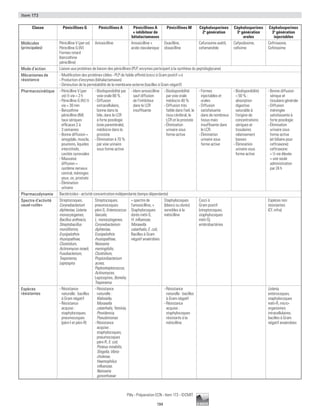
1. Adénopathies cervicales
T291-1 : Démarche diagnostique étiologique des adénopathies cervicales
Situation clinique Étiologies principales Démarche diagnostique paraclinique
Uni- ou bilatérales et
d’évolution aiguë
Infection tête et cou, EBV, CMV, toxoplasmose Simple surveillance si peu symptomatique et taille modérée
Si altération de l’état général ou persistance sans régression de taille 6 semaines :
- NFS, CRP
- IDR à la tuberculine (si BCG 10 ans)
- sérologies VIH, EBV et CMV
- autres sérologies selon histoire clinique (toxoplasmose, syphilis, tularémie, Brucella)
Unilatérales et d’évolution
aiguë
Particularités de l’enfant
Idem +
Adénite à pyogènes, surtout chez enfant 5 ans
(S. pyogenes et S. aureus)
Signes minimes : simple surveillance
Si signes importants (fièvre, adénopathie inflammatoire) : cytoponction à l’aiguille fine
(avec bactériologie standard, recherche d’anaérobies et de mycobactéries + cytologie)
Si signes généraux importants (altération de l’état général, adénopathie fluctuante,
cellulite en regard de l’adénopathie) : hémocultures, incision + drainage
(avec bactériologie standard, recherche d’anaérobies [porte d’entrée dentaire] et de
mycobactéries ± mycologie selon histoire + analyse anatomo-pathologique)
Bilatérales et d’évolution
subaiguë/chronique
EBV, CMV, VIH, toxoplasmose, syphilis
Rarement : maladie des griffes du chat, tuberculose
- NFS, CRP
- IDR à la tuberculine (si BCG 10 ans)
- Sérologies VIH, EBV, CMV, Bartonella si contact avec chat
- Dans un second temps : sérologie toxoplasmose, autres sérologies selon clinique,
radiographie thoracique
- Si pas d’étiologie et adénopathie persistante au terme de ce bilan : cytoponction voire
biopsie pour prélèvements en bactériologie, mycobactéries, mycologie, anatomo-
pathologie
Unilatérales et d’évolution
subaiguë/chronique
Tuberculose, maladie des griffes du chat, toxoplasmose
Lymphome, cancer ORL ou œsophage/thyroïde
Unilatérales et d’évolution
subaiguë/chronique
Particularités de l’enfant
Idem +
Mycobactéries non tuberculeuses, surtout chez enfant
5 ans
2. Adénopathies sus-claviculaires
ƒƒ Fréquemment associées à une cause néoplasique (thoracique si adénopathie sus-claviculaire droite et abdomino-pelvienne si adénopathie gauche).
ƒƒ Examens paracliniques systématiques : NFS, radiographie thoracique, voire cytoponction / biopsie.
3. Adénopathies axillaires
Évoquer en priorité : maladie des griffes du chat, autre pathologie d’inoculation, cancer du sein ou métastases, réaction inflammatoire à un corps
étranger (prothèse mammaire). Penser à une BCG-ite chez un enfant vacciné récemment.
4. Adénopathies épitrochléennes
Rechercher : infection locale de la main et de l’avant-bras, maladie des griffes du chat, lymphome/leucémie, sarcoïdose, tularémie ou autre pathologie
d’inoculation, syphilis. Penser aux mycobactéries non tuberculeuses chez l’enfant.
5. Adénopathies inguinales
Rechercher une infection ou un cancer dans le territoire de drainage (membres inférieurs, organes génitaux, périnée, paroi abdominale). Penser aux
infections sexuellement transmissibles.](https://image.slidesharecdn.com/poly-malinf2012-150207030832-conversion-gate01/85/Poly-mal-inf-2012-225-320.jpg)











