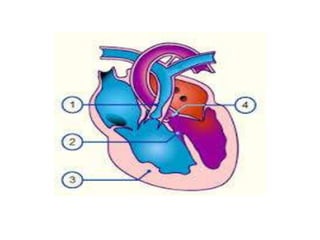
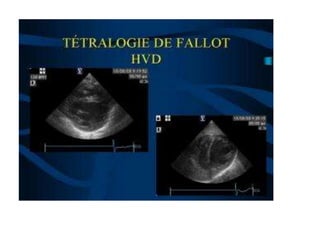
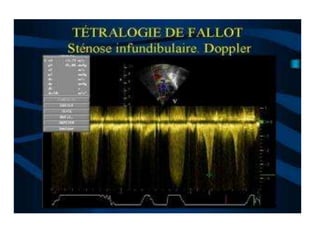
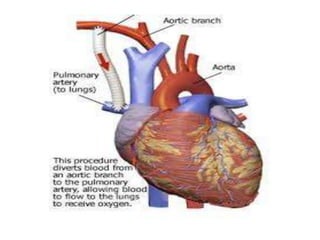
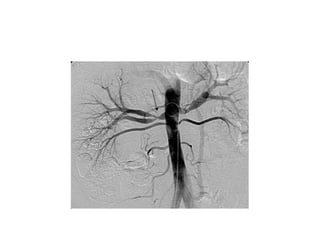
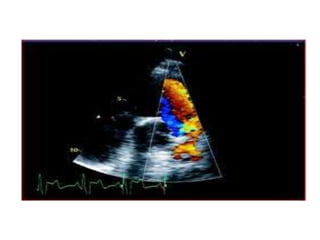
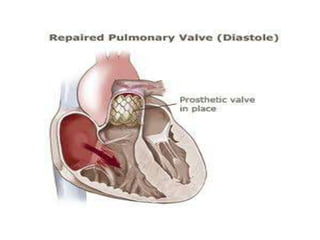
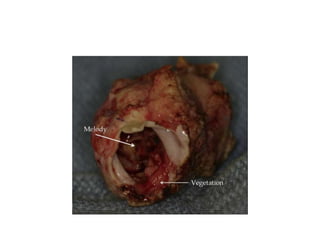
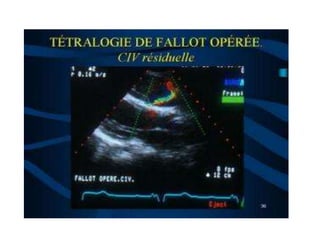
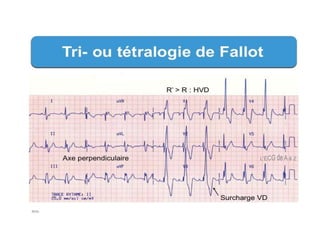
La tétralogie de Fallot est la cardiopathie cyanogène la plus fréquente, caractérisée par quatre anomalies structurelles cardiaques. Les complications incluent des crises hypoxiques et un risque élevé de morbidité tardive, avec un taux de survie de 86 % à 32 ans post-opératoire. Le diagnostic et le traitement précoces sont cruciaux, bien que des complications et des lésions résiduelles persistent souvent après la chirurgie.