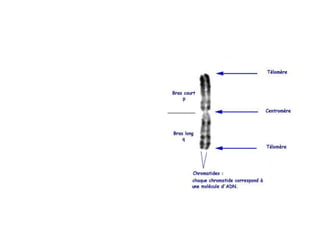
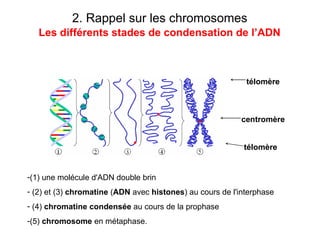
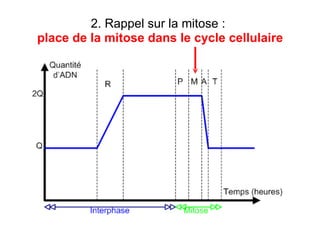
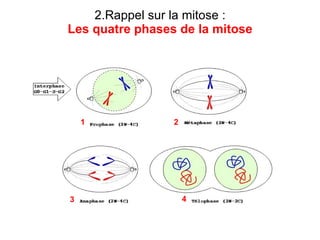
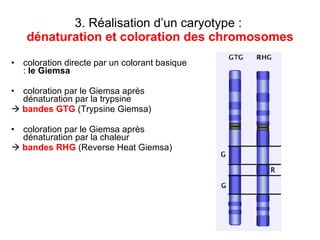
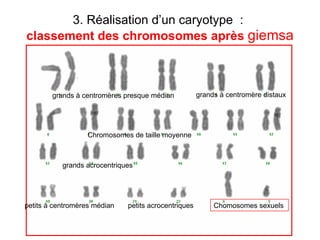
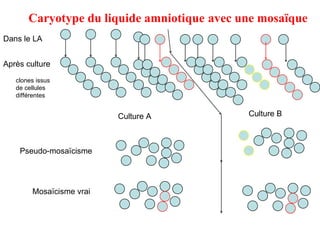
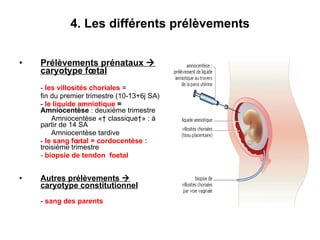
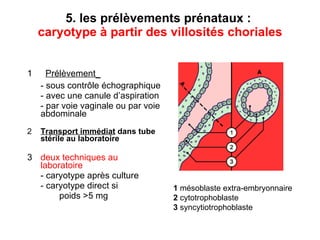
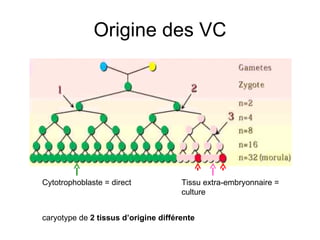
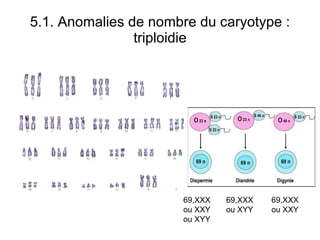
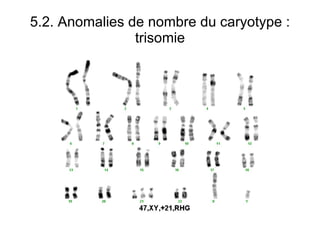
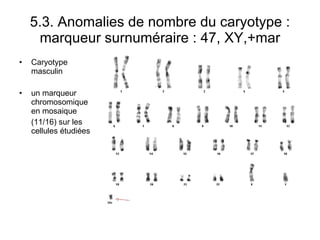
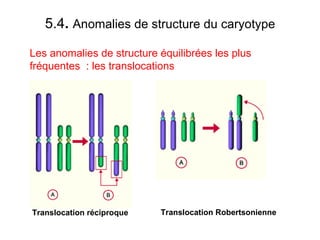
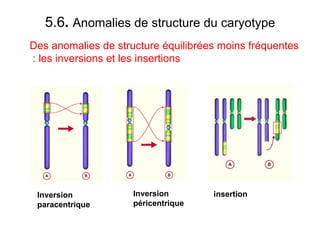
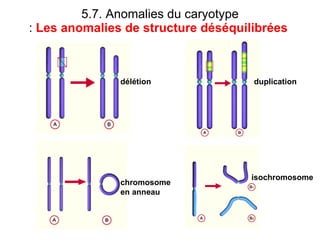
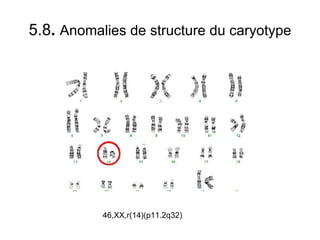
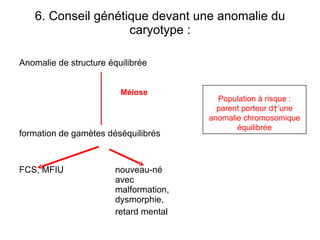
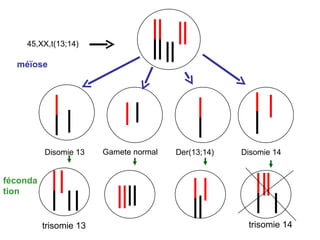
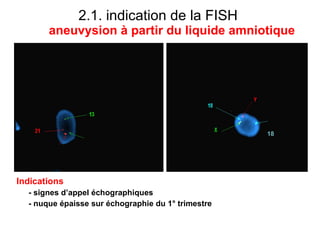
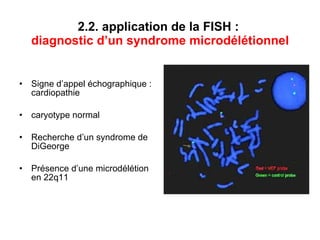
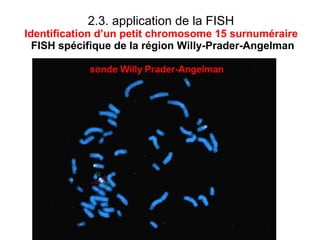
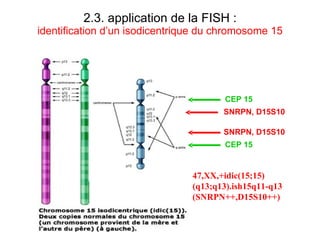
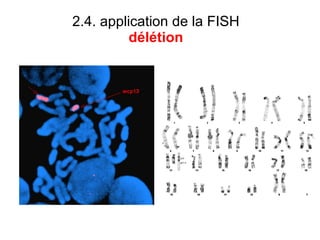
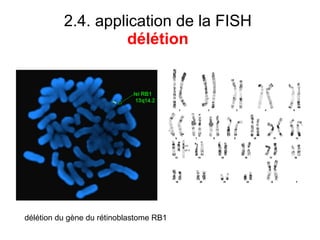
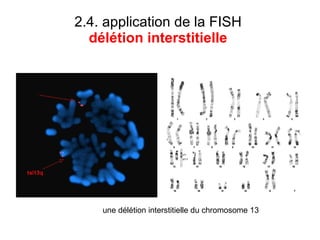
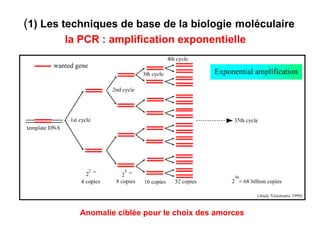
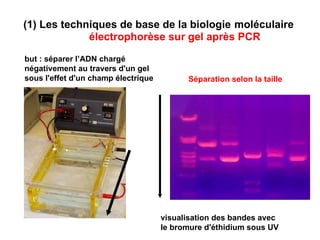
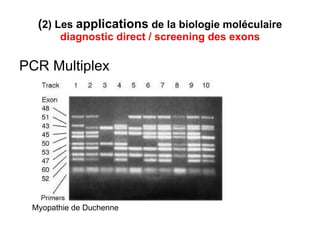
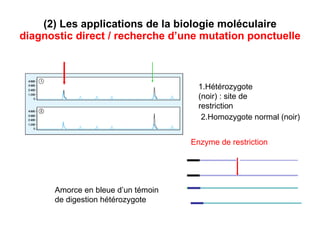
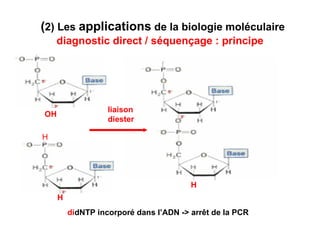
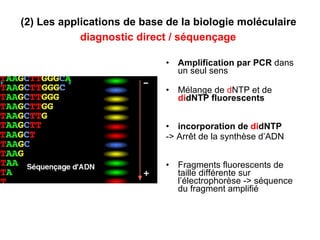
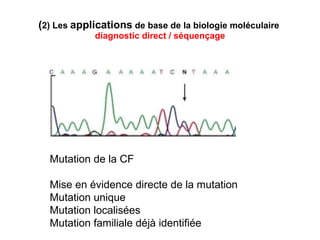
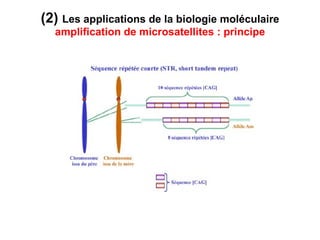
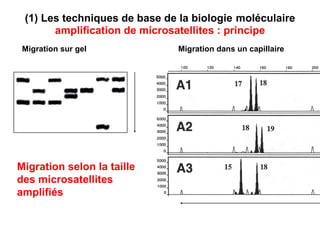
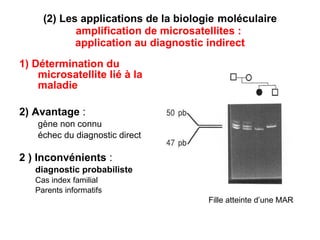
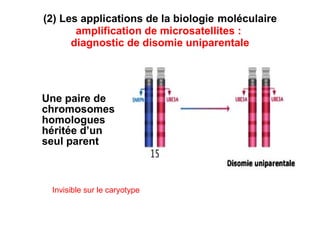
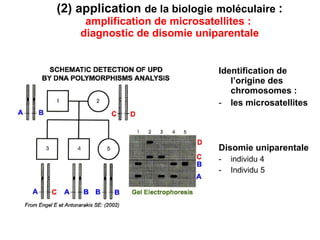
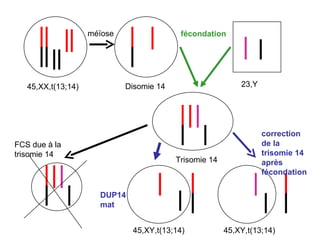
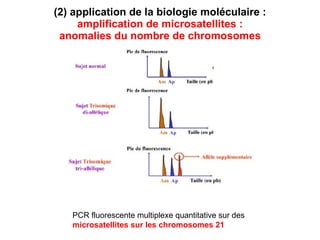
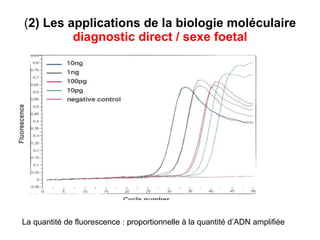
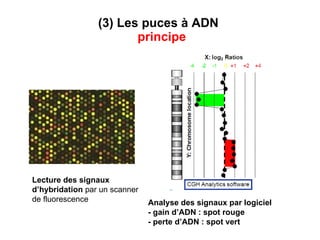
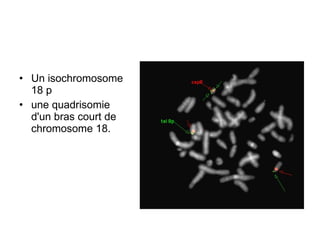
Ce document traite des diagnostics prénataux et des techniques de laboratoire en génétique, notamment l'exploration des dyschromosomies, telles que les triploïdies et les trisomies. Il décrit les méthodes d'analyse chromosomique, y compris le caryotypage et les techniques de biologie moléculaire comme la FISH, ainsi que les prélèvements nécessaires comme l'amniocentèse et la biopsie de villosités choriales. Le document souligne également l'importance du conseil génétique en cas d'anomalies chromosomiques détectées.