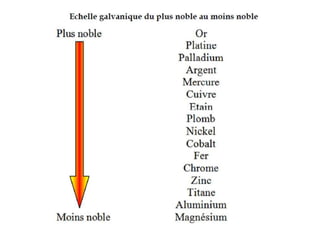
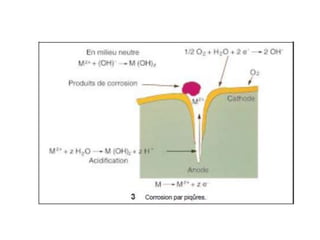
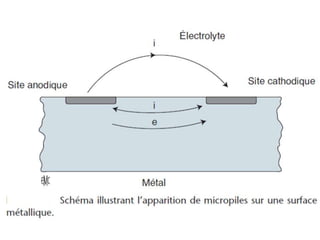
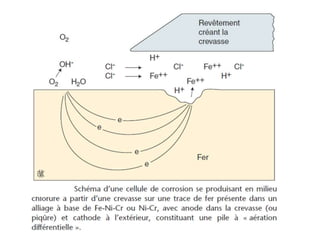
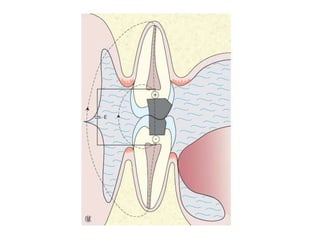
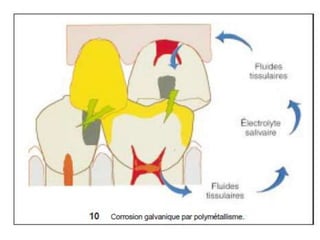
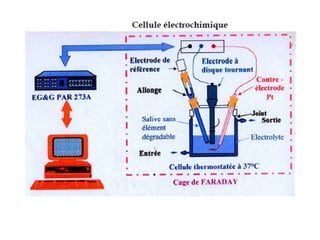
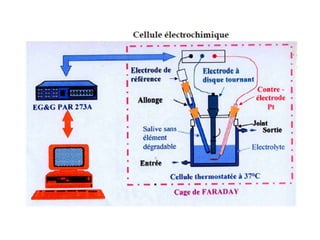
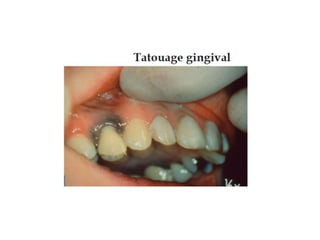
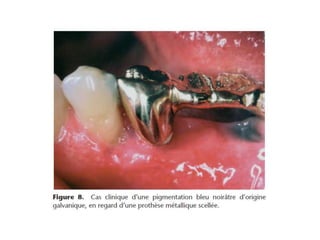
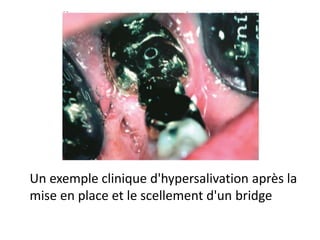
Le document traite de la corrosion des matériaux utilisés en odontologie, décrivant les types de corrosion, leurs mécanismes, et les méthodes d'évaluation de la résistance à la corrosion. Il souligne l'importance de la composition des alliages métalliques et de leur comportement électrochimique dans un environnement buccal corrosif. Enfin, des recommandations pratiques sont proposées pour limiter les risques de corrosion lors des restaurations dentaires.