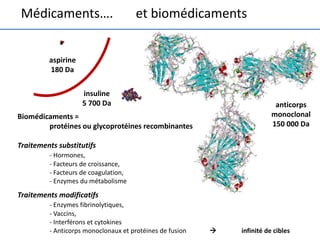
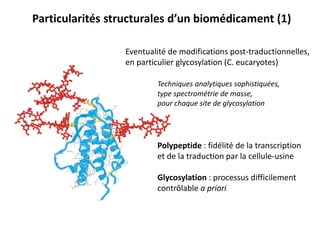
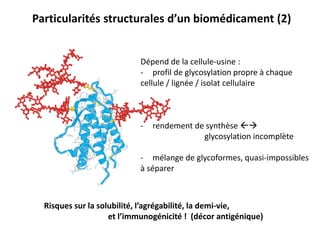
Le document traite des biomédicaments et biosimilaires comme des avancées majeures dans l'industrie pharmaceutique, avec un historique des anticorps thérapeutiques et des innovations dans leur production. Il souligne les différences entre médicaments et biomédicaments, notamment en termes de biodégradabilité, de spécificité de voie d'administration et de risques d'immunogénicité. Enfin, il aborde les défis liés à la reproduction des biomédicaments et le besoin de démontrer la biosimilitude pour les biosimilaires.