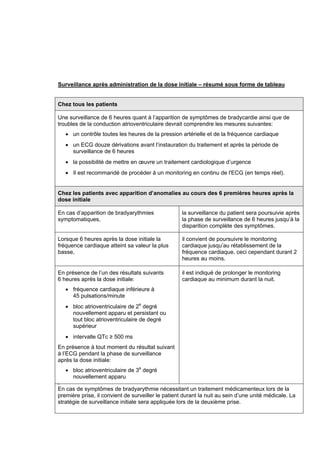
Le document informe des nouvelles contre-indications et recommandations liées au traitement par Gilenya (fingolimod) pour les patients atteints de sclérose en plaques, en raison de risques cardiaques. Il souligne la nécessité d'une surveillance stricte lors de l'administration initiale, en particulier chez les patients présentant des antécédents cardiaques. Il est également recommandé de consulter un cardiologue dans certains cas pour évaluer les risques avant d'instaurer le traitement.