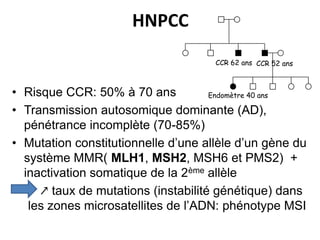
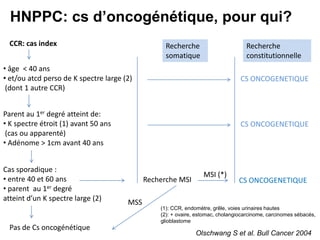
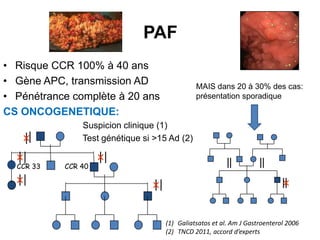
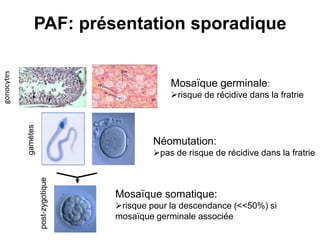
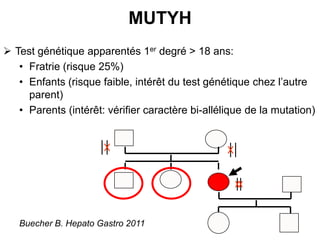
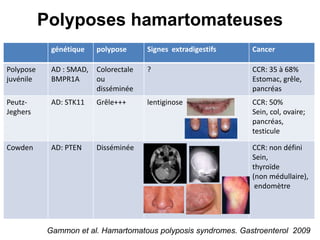
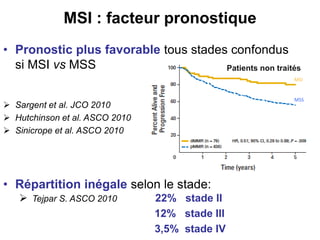
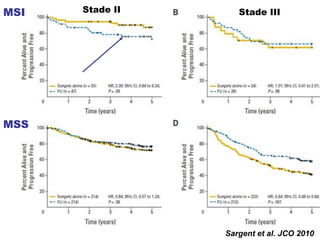
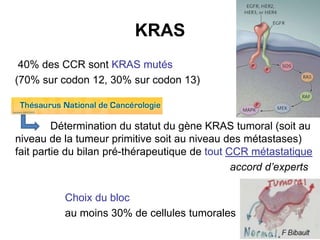
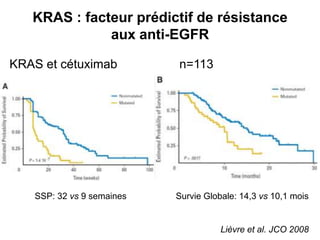
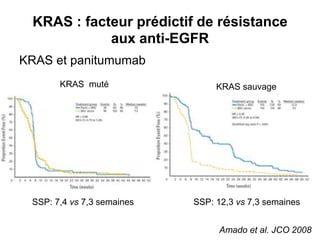
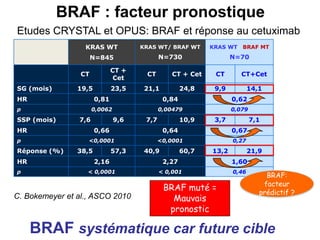
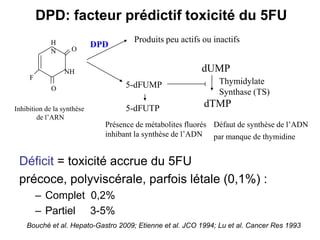
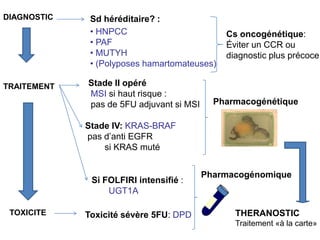
Le document traite de l'importance de la génétique dans le diagnostic et le traitement du cancer colorectal, soulignant le rôle des syndromes héréditaires et des anomalies génétiques dans la détermination du pronostic et de la réponse aux thérapies. Il aborde également les tests tels que le statut d'instabilité des microsatellites (MSI), DRP et la détermination des mutations KRAS et BRAF pour influencer les décisions thérapeutiques. Enfin, l'importance de la consultation en oncogénétique pour identifier les risques et orienter les traitements personnalisés est mise en avant.