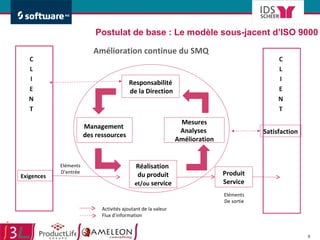
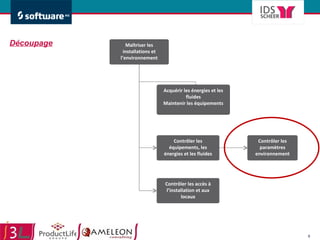
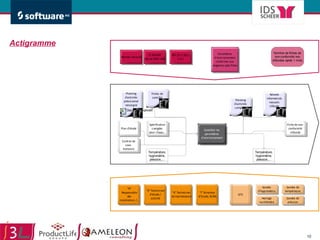
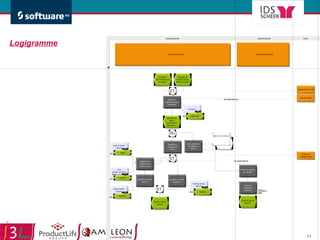
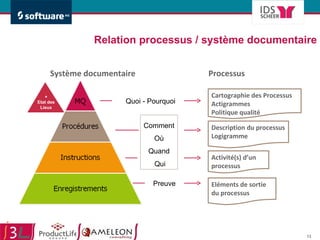
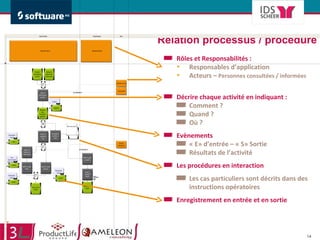
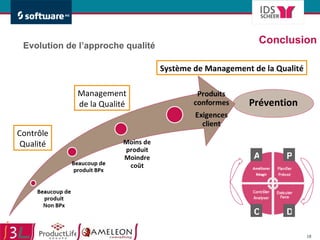
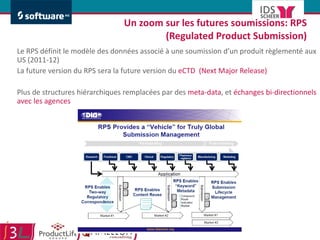
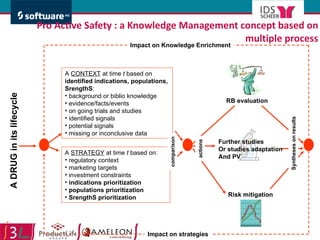
Le document traite de l'alignement des processus et des données dans les laboratoires pharmaceutiques et hôpitaux pour optimiser les systèmes de management de la qualité, en mettant l'accent sur la conformité réglementaire et l'amélioration continue. Il présente les bénéfices d'une approche processus pour simplifier la documentation, décloisonner les services et impliquer la direction et le personnel. Enfin, le texte examine les enjeux liés à la mondialisation et aux exigences croissantes de gestion de l'information dans l'industrie pharmaceutique.