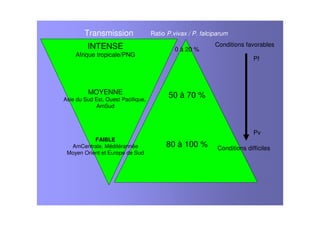
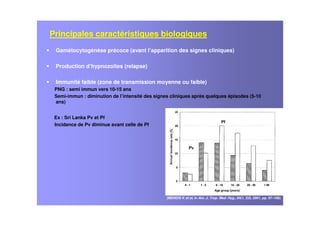
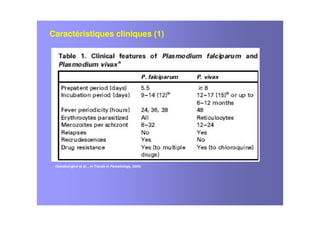
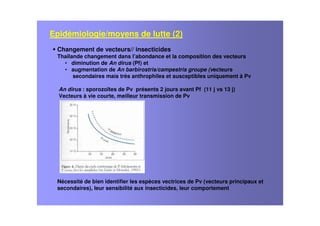
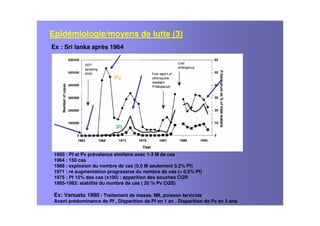
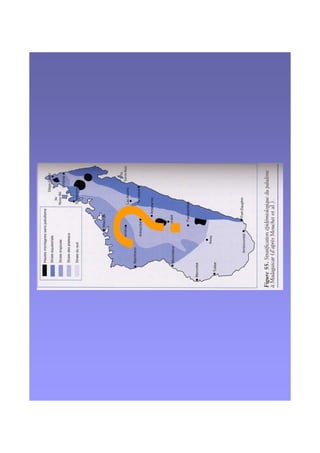
Le document examine le paludisme à Plasmodium vivax, soulignant sa prévalence et ses effets socio-économiques, notamment en Afrique. Il traite des caractéristiques cliniques, de l'épidémiologie, des traitements antipaludiques, et de la complexité des infections mixtes avec Plasmodium falciparum. Les défis liés à la résistance aux traitements et à la co-infection sont discutés, ainsi que les stratégies de vaccination en développement.