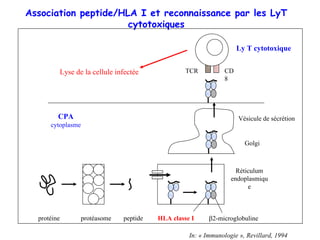
Le document explore l'influence des facteurs génétiques humains sur les réponses immunitaires au paludisme causé par Plasmodium falciparum. Il analyse les variations génétiques, y compris les allèles HLA, les polymorphismes érythrocytaires et les déficits enzymatiques, qui modulent la susceptibilité et la résistance au paludisme. En outre, il soulève des implications pour le développement de vaccins en s'appuyant sur les particularités génétiques des érythrocytes et des réponses immunitaires.