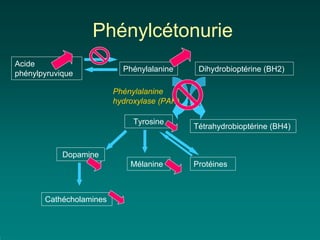
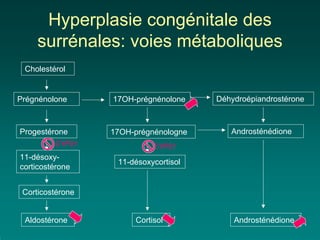
Le dépistage néonatal en France cible cinq maladies depuis 2003, dont la phénylcétonurie et l'hypothyroïdie congénitale, avec des méthodes de prélèvement sanguin précoces et un taux de couverture supérieur à 99%. La phénylcétonurie, une maladie métabolique, requiert un régime strict dès la naissance pour éviter des séquelles sévères, tandis que l'hypothyroïdie congénitale nécessite un traitement précoce par l-thyroxine pour un pronostic favorable. Les dépistages visent à identifier rapidement ces conditions pour permettre des interventions précoces et prévenir des handicaps irréversibles.