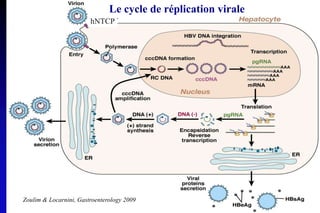
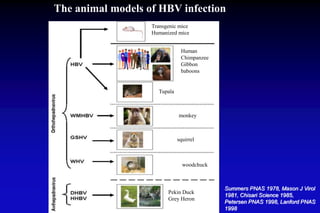
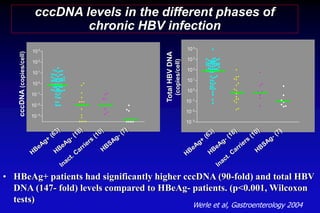
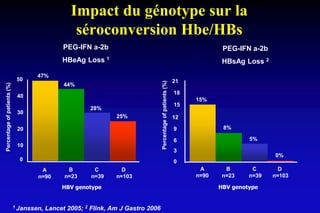
Le document traite de l'épidémiologie, de la virologie et des risques associés à l'infection par le virus de l'hépatite B (VHB), avec des statistiques sur la transmission, les populations à risque et les conséquences cliniques. Il souligne l'importance de la vaccination et des mesures de prévention en raison du nombre élevé de porteurs chroniques et des décès liés à l'hépatite B. Enfin, il aborde les modèles animaux, la pathophysiologie et la variabilité génétique du VHB, ainsi que les implications pour le traitement et le diagnostic.