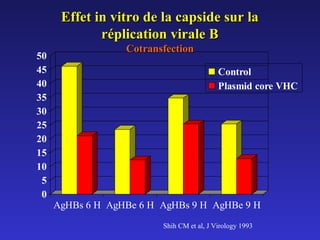
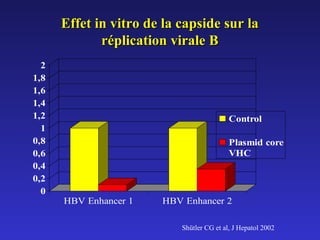
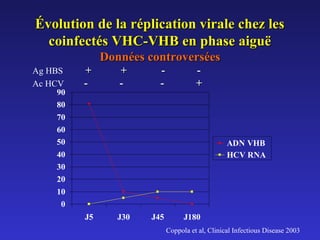
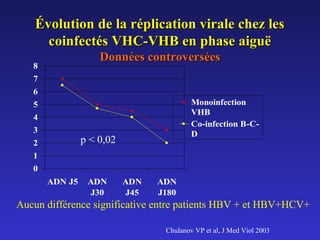
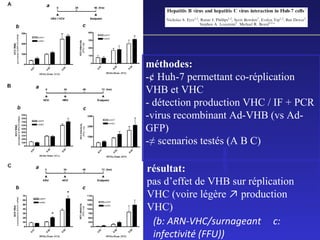
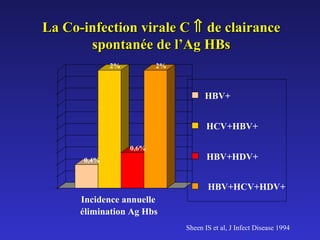
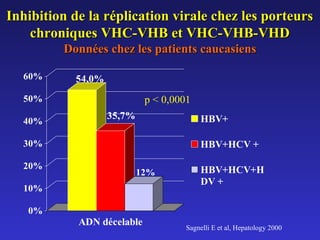
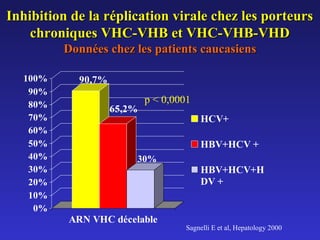
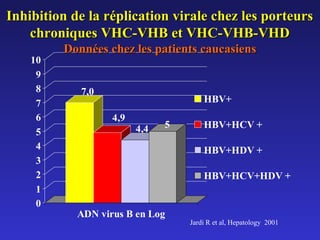
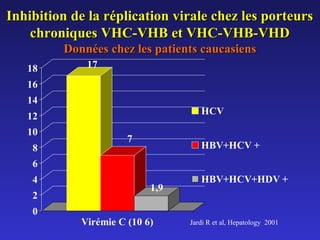
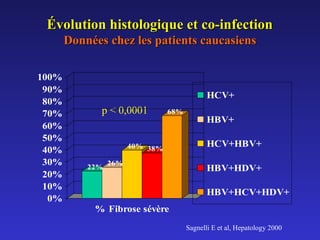
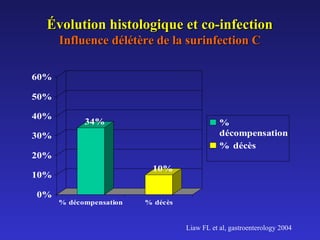
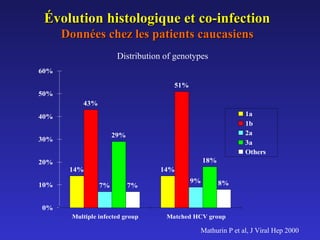
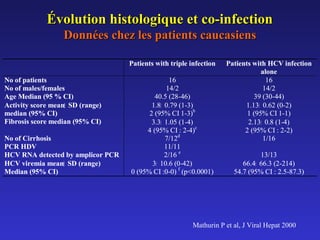
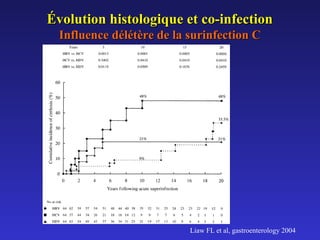
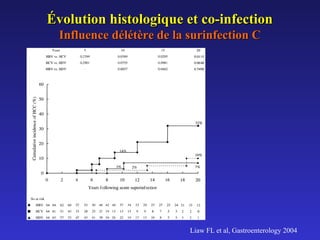
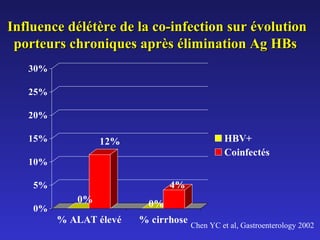
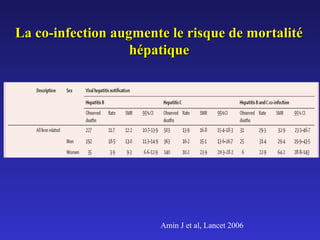
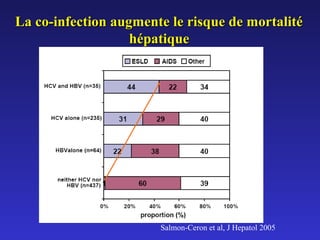
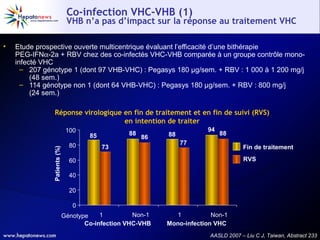
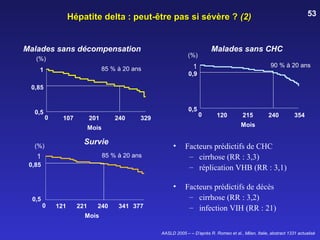
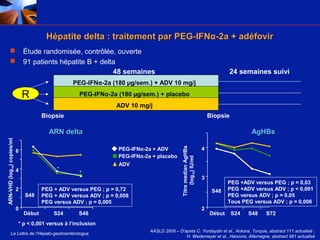
Le document traite de la co-infection par le VHB et le VHC, soulignant les interactions complexes entre ces virus et leurs effets sur la réplication virale en culture. Il révèle que ni le VHB ni le VHC n'inhibent directement la réplication de l'autre dans des hépatocytes co-infectés et que des facteurs liés à l'hôte jouent un rôle majeur dans la dynamique de la co-infection. Enfin, il discute des conséquences cliniques de la co-infection, y compris l'impact sur la réponse au traitement antiviral et le risque d'évolution vers la chronicité et la mortalité hépatique.