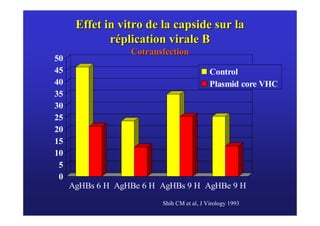
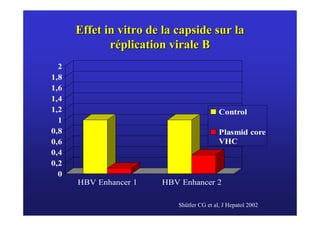
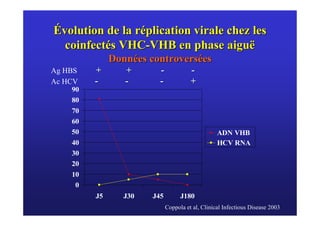
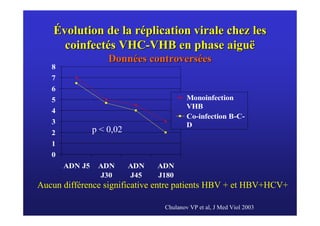
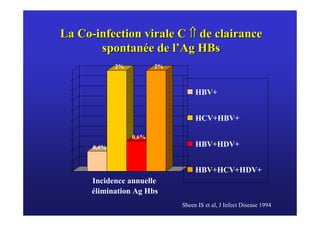
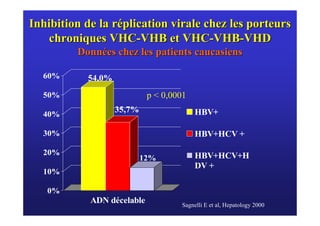
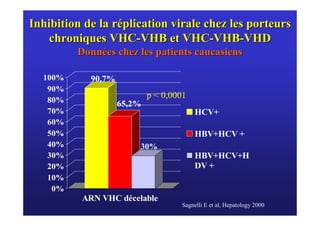
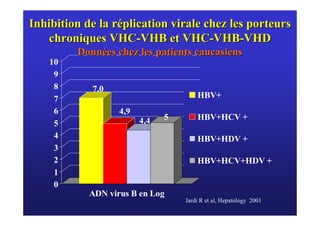
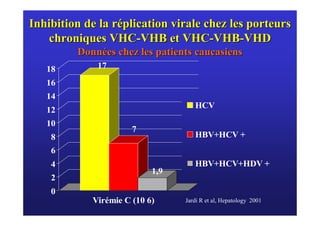
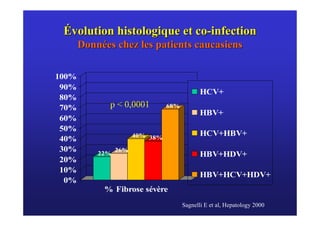
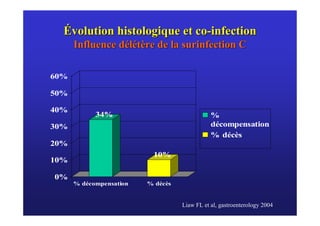
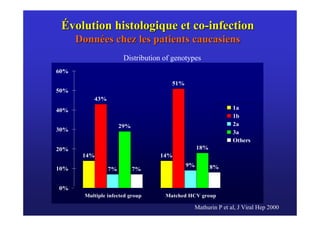
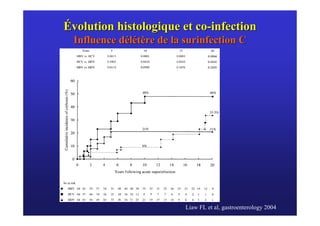
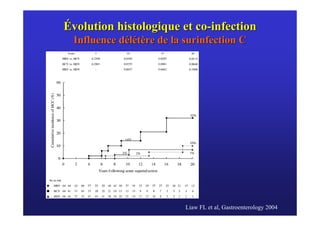
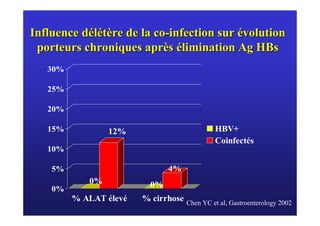
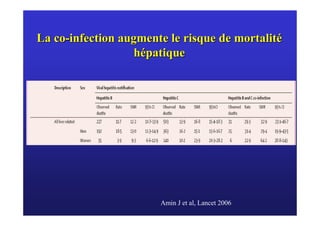
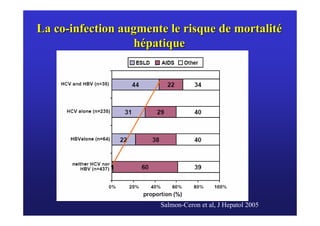
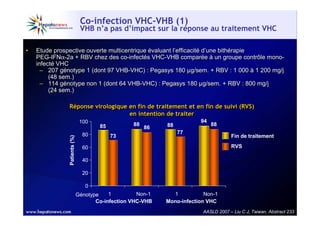
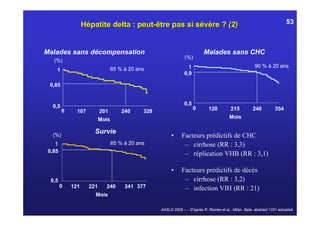
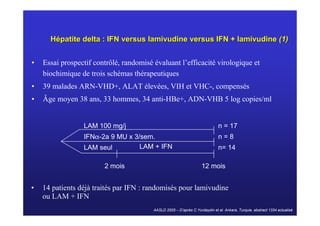
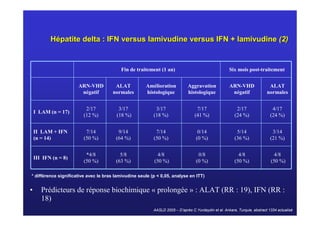
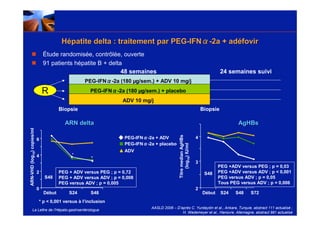
Le document traite de la co-infection virale par le VHC et le VHB, en examinant son impact sur la réplication virale, l'évolution histologique et la réponse au traitement. Les données révèlent une influence délétère de la co-infection sur la sévérité de la maladie hépatique et le risque de mortalité. Les études mentionnées indiquent également que la co-infection peut affecter la réponse au traitement antiviral sans interférer spécifiquement avec la réplication du VHB.