Zarski diu hépatites virales janvier 2015 jpz
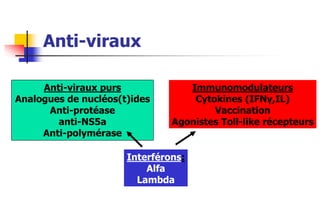
- 1. Anti-viraux Anti-viraux purs Analogues de nucléos(t)ides Anti-protéase anti-NS5a Anti-polymérase Immunomodulateurs Cytokines (IFNγ,IL) Vaccination Agonistes Toll-like récepteurs Interférons: Alfa Lambda
- 2. Antiviraux Hépatite B Interféron α Analogues de: Nucléosides Nucléotides Nouvelles cibles Hépatite C Interféron α Autres interférons Ribavirine Anti-protéases Anti-polymérase: NS5B Nucléosidiques Non nucléosidiques Anti-NS5a Inhibiteurs d’entrée Agonistes Toll-like récepteurs
- 3. INTERFERONS . Protéines ou glycoprotéines . Spécifiques de l’espèce . Agissant sur la cellule cible (récepteur) . Expression de certains gènes : synthèse des ARNm et protéines
- 4. INTERFERONS Caractéristiques IFN INF IFN Cellules Leucocytaire (lympho T et B macrophage) Fibroblastique Lympho T Structure G20 Kda 165 AA GP 20 Kda 165 AA GP 17 Kda 146 AA Chromosome Inducteurs 9 p 21 virus, polyribonucléotides 9 p 21 virus, polyribonucléotides 12 Antigènes Mitogènes des lympho T
- 5. INTERFERONS Récepteurs . Spécifiques présent à la surface des cellules . et # . Haute constance d’affinité . Nombre de sites récepteurs faible
- 7. INTERFERON Mécanisme d’action P STAT-1 P P STAT ISRE 48 P STAT-1 STAT-1 STAT-2 STAT-2 Tyk-2 Jak-1 IFN Tyk-2 et Jak-1 =Tyrosines kinases STAT S = facteurs de transcription ISRE = Interferon Sensitive Response Element
- 8. INTERFERONS 1°) Expression induite : - 2 ’5 ’ OAS - Protéine kinase, Mx - CMH I et II - Beta 2 microglobuline - Xanthine oxydase - Récepteur du TNF 2°) Expression inhibée - c-myc, c-fos - collagène
- 9. INTERFERON Action des principales enzymes induites : 1°) 2’ 5’ oligoadénylate synthétase : - catalyse synthèse d’oligomères d’adénine - oligomères activent endonucléase - destruction des ARN viraux 2°) Protéine kinase P1 - Sérine thréonine kinase - initiation de la synthèse protéique
- 10. INTERFERON ALPHA Effet immunomodulateur IFN IFN IFN IFN HLA II Th0 Th2 Activation Cellule B Prolifération Anticorps IFN Activation IL12 rIL12 Th1 CTL NK HLA I
- 11. CHARACTERISTIQUES DES IFN-PEG Taille: 40kDa Structure: branché Dose fixe Clairance hépatique Taille: 12kDa Structure: linéaire Dose adaptée au poids Clairance rénale PEG-IFN 2a PEG-IFN 2b
- 12. Antiviraux Hépatite B Interféron α Analogues de: Nucléosides Nucléotides Hépatite C Interféron α Autres interférons Ribavirine Anti-protéases Anti-polymérase: Nucléosidiques Non nucléosidiques Inhibiteurs d’entrée Agonistes Toll-like récepteurs
- 14. ADN VHB sous IFN-PEG a2a et séroconversion HBe EASL 2006 – T. Piratvisuth, abstract 49 2,30 log10 cp/ml Séroconversion HBe et HBs à S72 (n = 8) -3,8 log10 cp/ml -5,84 log10 cp/ml 10 000 cp/ml Pas de séroconversion HBe à S72 (n = 184) Séroconversion HBe à S72 (n = 87) 12 10 8 6 4 2 0 ADNVHBmoyen(log10cp/ml) 0 12 24 36 48 60 72 Semaines Traitement Suivi 33 % 29 % 38 % Période de Survenue séroconversion HBe
- 15. MOLECULES ANTIVIRALES Analogues de nucléos(t)ides Guanine . Entécavir Adénine . Ara-MP Analogues fluorés . FIAU (Uracyl) Phosphonates de nucléosides acycliques . Adéfovir, Ténofovir Analogues de pyrophosphates . Foscarnet Analogues lévogyres de nucléosides . Lamivudine (Cytidine) . FTC ou Emtricitabine (Cytidine) . L-dT (Telbivudine) . LFD4C (Cytidine)
- 16. ANALOGUES DE NUCLEOSIDES Efficacité Bonne captation cellulaire Phosphorylation par les kinases cellulaires (tri- phosphate) Degré de compétition avec les nucléosides naturels endo-cellulaires Efficacité de la liaison à la polymérase virale et de son incorporation dans la chaine d ’ADN naissante
- 18. TRANSLOCATION et ELONGATION Lamivudine Emtricitabine Entécavir 3 ’ AAA POL 5 ’ AATG DR1 Adéfovir Ténofovir
- 19. ENTECAVIR Analogue de la guanine Inhibiteur sélectif et puissant du VHB (EC50 = 4 nM, Ki = 1 nM) Agit à 3 niveaux de la polymérase: Initiation Synthèse ADN-dépendante Reverse transcription N NH N N OH OH O CH2 NH2
- 20. 0 0,5 1 1,5 2 2,5 3 3,5 0 1 2 3 4 6 8 Placebo 0.05 mg 0.1 mg 0.5 mg 1.0 mg Dosing Weeks ENTECAVIR :ADN VHB
- 21. TENOFOVIR Analogue nucléotidique (monophosphorylé) Utilisé dans le VIH depuis 2000 Inhibe l’ADN Polymérase Terminateur de chaine Plus efficace que l’Adéfovir Aucune mutation de résistance à 6 ans Tolérance rénale bonne mais: Clairance à surveiller Hypophosphorémie
- 22. Réduction de l’ADN du VHB après 1 an de Traitement -8 -7 -6 -5 -4 -3 -2 -1 0 ADV1 10 mg ADV2 30 mg LAM3 LdT3 ETV4 TDF5 -3,5 -4,8 -5,5 -6,5 -6,9 -6,4 *Données issues d’études indépendantes, ne permettant pas de comparaisons (populations différentes, valeurs initiales de charges virales et méthodes de quantifications de l’ADN du VHB différentes) Patients AgHBe-positifs 1Hepsera [RCP]; 2Marcellin et al., N Engl J Med 2003, 348: 808-16; 3Sebivio [RCP]; 4Baraclude [RCP]. 5Heathcote et al., AASLD 2007, abstract LB6; Fontana R.J., Gastroenterlogy 2009, 136(2):389-92. Réductiondel’ADNduVHB à1an(Log10)
- 23. 845 a.a. Terminal protein spacer Pol/RT RNaseH A B C ED 1 183 349 692 YMDD V173L L180M M204I/V GVGLSPFLLA I(G) II(F) (rt1) (rt 344) MUTATIONS DE RESISTANCE LAM / FTC ETV T184G S202I M250V ADV A181V N236T LdT M204I Allen Hepatology 1998, Delaney J Virol 2003, Angus Gastroenterology 2003, Villeneuve J Hepatol 2003, Lai AASLD 2003, Colonno HepDart 2003
- 24. LVD1 ETV*5,6 LdT†2,3 ADV‡1 TDF§4 Résistance à 6 ans § Patients avec ADN VHB ≥400 copies/mL à S72 peuvent ajouter FTC au TDF; ainsi la résistanceau TDF monotherapie après 72 semaines ne peut pas être totallement certifiée5,6 * probabilité cumulée d’apparition de résistance; † AgHBe (+) naïf; ‡ AgHBe(-) Naïf; N/A non disponible Année 3 1.2% 0% 55% 11% Année 4 1.2% – 0% 71% 18% Année 2 <1% 0%§ 46% 3% 25% Année 1 <1% 0% 23% 0% 5% Année 5 – 0% 80% 29% 1.2% Année 6 0% – – – 72 SEMAINES 1. Locarnini S. Hepatol Int. 2008;2:147-51. 2. Lai CL, et al. N Engl J Med, 2007;357:2576-8; 3. Liaw YF, et al. Gastroenterology 2009;136:486-95. 4. Snow-Lampart A, et al. AASLD Oct 31–Nov 4, 2008, San Francisco, USA. Oral Presentation 977 Hepatology 2008;48:745A. 5. Baraclude EU SmPC, February 2009. 6. Tenney et al. EASL April 22–26, 2009, Copenhagen, Denmark, Oral – 1.2%
- 25. TOLERANCE Rash Tenofovir Adefovir Lamivudine Telbivudine Entecavir Amylase,lipase Peripheral neuropathy Myalgia, rhabdomyolyse CPK Pancreatite Nécrose tubulaire ClCréatinine Hypophosph atemie Acidose lactique Thrombocyto penie Dyspnée Malaise Céphalées Gastrointesti nal Vertige Très fréquent: 1/10 Rare: 1/1,000-1/10,000 fréquent: 1/100-1/1,000 Très rare: >1/10,000 Expert Panel Italian Guidelines STI review 2009;2:14-27.
- 26. Les molécules du futur? Les inhibiteurs d’entrée: Peptide pré-S (myrcludex-B) Prévient l’infection La formation du ccc-DNA: 2 composants récemment identifiés Modulation de l’activité transcriptionnelle: Protéines à doigt de zinc Acétylation ou méthylation des histones Les inhibiteurs de l’assemblage ou de la stabilité Les boosters de la réponse immune: Les agonistes des TL-récepteurs La restauration des fonctions cellulaires T (vaccins)
- 27. Antiviraux Hépatite B Interféron α Analogues de: Nucléosides Nucléotides Hépatite C Interféron α Autres interférons Ribavirine Anti-protéases Anti-polymérase: Nucléosidiques Non nucléosidiques Inhibiteurs d’entrée Agonistes Toll-like récepteurs
- 28. RIBAVIRINE Analogue nucléosidique de la purine Forme active: ribavirine triphosphate Effet anti-viral: Réplication virale: faible ( 0,3 Log) 2 ’5 ’ OAS en synergie avec l ’interféron Inhibition de l ’IMPDH Réduction de synthèse de GTP Mutations possibles (NS5b)
- 29. MECANISME D’ACTION DE LA RIBAVIRINE Glutamine PRA IMP (Inosine monophosphate) XMP (Acide xanthylique) GMP, GDP, GTP Ribavirine Ribavirine - MP
- 31. Cinétique virale: Apport de la ribavirine Feld et al, Gastroenterology 2010
- 32. Organisation du génome VHC et maturation de la polyprotéine Asselah T et al. Liver International 2009;29(s1):57-67. C E1 E2 p7 NS2 NS3 4A NS4B NS5A NS5B NS2/3 protéase Host signal peptidase Host signal peptide peptidase NS3/4A protéase Serine protéase Hélicase CofacteurSeri ne protéase ARN-polymérase ARN-dépendanteProtéaseGlycoprotéines d’enveloppe Core Protéines structurales Protéines non-structurales Cadre de lecture TRADUCTION MATURATION 5’NCR 3’NCR NCR : Non Coding Region
- 33. Cycle du VHC et cibles des anti-viraux
- 35. Les anti-viraux directs I protéase Anti-NS5a I polymérase nucléotidique I Polymérase non nucléotidique Giléad GS-9451 GS-9857 Ledipasvir GS-5816 Sofosbuvir GS-9669 Abbvie Paritaprévir/r Ombitasvir ABT-530 Dasabuvir Merck (MSD) Grazoprévir Elbasvir MK-8408 Samatasvir MK-3682 IDX-459 MK-8876 BMS Asunaprévir Daclatasvir Béclabuvir Janssen (J&J) Siméprévir GSK-2336805 TMC-055/r Achillion Sovaprévir ACH-3102 ACH-3422
- 36. Cibles Thérapeutiques NS3 Site de fixation du substrat de la protéase Site catalytique de la protéase Site de fixation du zinc Site de fixation du substrat de la protéase NS2/NS3 Site d’attachement à la membrane de la protéase-hélicase Site de fixation du substrat de la protéase Site de fixation de NS4A Pawlotsky JM, Chevaliez S, McHutchison JG, Gastroenterology 2007
- 37. Anti-protéase Mécanismes Inhibe la sérine protéase NS3/NS4 responsable du développement de la poly-protéine et de la production de nouveaux virions G1a et 1b Faible barrière de résistance Effets II: anémie, prurit, dysgueusie, rash, photosensibilité, bilirubine Molécules Siméprévir (Olysio®, Janssen) Bocéprévir, Télaprévir Asunaprévir (BMS) Paritaprevir/r (Abbvie) Grazoprevir (MSD) Sovaprevir (Achillion) GS-9451 (Gilead) GS-9857 (Gilead)
- 39. Les anti-protéases de 2ème génération sont plus puissantes : comparaison des 2 molécules MSD 69 96 0 10 20 30 40 50 60 70 80 90 100 Bocéprévir MK-5172 S 12 PCR (-) à S12
- 40. Les anti-NS5A Mécanismes Inhibe la NS5A Modulation de la réplication Assemblage Régulation de la réponse interféron endogène Tous génotypes Faible barrière de résistance Molécules Daclatasvir (Daclinza®, BMS) Lédipasvir (Gilead) Ombitasvir (Abbott) Elbasvir (MSD) Samatasvir (MSD) ACH-3102 (Achillion)
- 41. Polymérase virale: cibles des molécules
- 43. Inhibiteurs de la Polymérase Nucléosidiques: Analogues de substrats naturels NS5B: très conservée Inhibition compétitive Liaison au site catalytique Tout génotype Haute barrière de résistance Non nucléosidiques Liaison à 1/5 sites allostériques Changement conformationnel du site catalytique Génotype spécifique (1a et 1b) Faible barrière de résistance Sélection de mutants
- 44. Inhibiteurs de la Polymérase Analogues nucléosidiques: Sofosbuvir (Sovaldi®,Gilead) MK-3682 (MSD) IDX-459 ACH-3422 (Achillion) Inhibiteurs non nucléosidiques Dasabuvir (Abbvie) Becabluvir (BMS) MK-8876 (MSD) TMC-055/r (Janssen)
- 45. Les associations sans interféron Bithérapie Trithérapie Quadrithérapie
- 46. Siméprévir+Sofosbuvir (Cosmos): 12 semaines (N=27) (N=14) (N=27) (N=14) Presse release
- 47. Réponse virologique • Les 21 malades qui ont fait la visite de suivi semaine 24 ont tous un ARN VHC indétectable (RVS24) ** Pas de donnée pour 1 malade à la visite suivi semaine 12 : ARN VHC était indétectable aux visites de suivi semaine 4 et semaine 24 (préliminaire) Sofosbuvir + Daclatasvir (12 semaines) 91 % 100 % 100 % 100 % 100 % 80 % 95 % 100 % 100 % 95 %** 0 20 40 60 80 100 S2 S4 S24 RVS4 RVS12 DCV + SOF DCV + SOF + RBV Manquant 21 20 21 20 21 20 21 20 21 20n = MaladesavecARNVHC<LDQ*(%) *LDQ : ARN VHC < 25 UI/ml Sulkowski M, USA, EASL 2013, Abs. 1417 actualisé
- 48. Sofosbuvir + daclatasvir 12 semaines chez les patients de génotype 3 152 patients G3 Nelson DR, Etats-Unis, AASLD 2014, Abs. LB-3 actualisé 91/101 11/19 44/51 32/34 90 % 80 100 91/101 Tous Sans cirrhose Echec de traitement Cirrhose Naïfs 73/75 11/19 97 % 58 % 86 % 94 % 69 % 44/51 32/34 9/13 60 40 20 0
- 49. Sofosbuvir+Lédipasvir 97.7 93.697.2 96.494 2 93.1 G1 naifs G1 prétraités RVS 12 semaines SOF/LDV SOF/LDV+RBV SOF/LDV SOF/LDV2 12 semaines 8 semaines Presse release
- 50. Sofosbuvir/ledipasvir + RBV 12 sem. chez les patients cirrhotiques G1 en échec de trithérapie avec IP 75/7774/77 LDV/SOF 24 sem. LDV/SOF + RBV 12 sem. 3 rechutes 2 rechutes Bourlière M , France, AASLD 2014, Abs. LB-6 actualisé Réponse virologique soutenue
- 51. Ledipasvir/sofosbuvir chez les patients G4 **1 Retrait consentement + 1 patient n’ayant pas atteint 12 sem. post-traitement Schéma de l’étude RVS12 Kapoor R, Etats-Unis, AASLD 2014, Abs. 240 actualisé S6 LDV/SOF (n = 21) RVS12 S0 S12 Patients G4 • Naïfs : 62 % - Prétraités : 38 % • Fibrose F3-F4 : 43 % RVS12 95 %** (19/20) 0 20 40 60 80 100
- 52. LDV/SOF + RBV chez des patients ayant une cirrhose décompensée (4) 87 87 8689 89 90 0 20 40 60 80 100 Child Pugh B Child Pugh C RVS12(%) Tous 45/52 42/47 LDV/SOF + RBV 12 sem. LDV/SOF + RBV 24 sem. 3 rechutes 1 DC 1 rechute 2 DC 1 rechute 1 DC 1 Perdu Vue 1 rechute 1 DC RVS12 Flamm SL, Etats Unis, AASLD 2014, Abs. 239 actualisé 6 sujets transplantés exclus de l’analyse 3 sujets n’ont pas atteints RVS12 26/30 19/22 18/2024/27
- 53. Sofosbuvir + GS-5816 + RBV pour 12 sem. chez les patients en échec G1 ou 3 Réponse Virologique Soutenue RVS 12 85 96 100 100 0 20 40 60 80 100 4 rechutes 1 rechute Génotype 3 en échec sans cirrhose GS-5816, mg RBV 22/26 25 ‒ 27/28 27/27 26/26 25 + 100 ‒ 100 + Pianko S, Australie, AASLD 2014, Abs. 197 actualisé RVS12(%)
- 54. Sofosbuvir + GS-5816 + RBV pour 12 sem. chez les patients en échec G1 ou 3 Réponse Virologique Soutenue RVS 12 Génotype 3 en échec avec cirrhose 11 rechutes 3 rechutes 1 retrait consentement 3 rechutes 1 rechute 15/26 25 ‒ 21/25 23/26 25/26 25 + 100 ‒ 100 + GS-5816, mg RBV Pianko S, Australie, AASLD 2014, Abs. 197 actualisé RVS12(%)
- 55. 96 100 91 100 93 93 0 20 40 60 80 100 26/27 28/28 10/11 10/10 25/27 25/27 100 86 100 100 100 0 20 40 60 80 100 7/7 6*/7 1/1 4/4 5/5 RVS12(%) RVS12(%) G1 G2 G3 G4 G5 G6 SOF + GS-5816 25 mg SOF + GS-5816 100 mg * 1 G4 perdu de vue Sofosbuvir + GS-5816 + RBV pendant 8-12 sem. chez les patients naïfs non cirrhotiques G1-6 Tran T, Etats Unis, AASLD 2014, Abs. 80 actualisé RVS 12 avec le schéma de 12 semaines (sans RBV)
- 56. ABT-450/r/ombitasvir + dasabuvir + RBV chez les patients G1 cirrhotiques RVS 12 selon les sous types viraux et la charge virale 0 20 40 60 80 100 G1a G1b < 800 000 UI/ml > 800 000 UI/ml 160 174 149 153 115 121 124 140 RVS12(%) 51 51 67 68 17 19 31 34 12 semaines 24 semaines 88,6 95,0 100 91,2 89,5 92,0 97,498,5 Sous-type viral Charge virale initiale Fried M, Etats-Unis, AASLD 2014, Abs. 81 actualisé
- 57. ABT-450/r/ombitasvir + dasabuvir + RBV chez les patients G1 cirrhotiques RVS 12 selon la réponse à PEG-IFN/RBV 0 20 40 60 80 100 Naïfs Rechuteurs Répondeurs partiels Répondeurs nuls 65 75 59 62 71 74 81 86 RVS12(%) 23 23 28 29 13 13 17 18 12 semaines 24 semaines 94,2 95,9 100 94,4 100 86,7 95,296,6 Fried M, Etats-Unis, AASLD 2014, Abs. 81 actualisé
- 58. MK-5172 (grazoprevir) + MK-8742 (elbasvir) + RBV pendant 12 à 18 sem. chez G1 naïfs cirrhotiques ou répondeurs nuls Lawitz E, Etats-Unis, AASLD2014, Abs. 196 actualisé RVS 12 en fonction des caractéristiques et des traitements Naïfs Nuls Cirrhose Sans cirrhose G1bG1a (%) 0 100 80 60 20 40 95 94 93 94 9599 95 95 +RBV No RBV 122/128 118/125 152/163 86/87 116/123 124/130 161/170 79/83
- 59. Sofosbuvir+ACH- 3102 Essai de phase 2 ACH-3102:anti-NS5a de 2ème génération 6 semaines 18 patients 12 G1a, 2 G1b SVR4:100% Aucun effet secondaire En réserve: ACH-3422:anti-NS5b
- 60. Et les génotypes 2 et 3?
- 61. Comparaison des études sofosbuvir et RBV chez les malades génotype 2 ou 3 Cirrhose G3 Gane E, Nouvelle-Zélande, EASL 2013, Abs. 5 actualisé Jacobson IM, USA, EASL 2013, Abs. 61 actualisé Nelson D, USA, EASL 2013, Abs. 6 actualisé POSITRON : SOF + RBV 12 semaines FISSION : SOF + RBV 12 semaines FISSION : PEG-IFNα-2a + RBV 24 semaines FUSION : SOF + RBV 12 semaines FUSION : SOF + RBV 16 semaines RVS12(%) 21 34 30 19 61 0 20 40 60 80 100 13/38 11/373/14 5/26 14/23 POSITRON FISSION FUSION
- 62. Etude VALENCE : sofosbuvir chez G2/3 RVS12 chez patients G2 traités 12 semaines RVS12 chez patients G3 traités 24 semaines 0 20 40 60 80 100 RVS12(%) 97 29/30 Non cirrhotiques naïfs 100 Cirrhotiques naïfs 2/2 91 Non cirrhotiques déjà traités 30/33 Cirrhotiques déjà traités 7/8 88 0 20 40 60 80 100 RVS12(%) 94 86/92 Non cirrhotiques naïfs 92 Cirrhotiques naïfs 12/13 87 Non cirrhotiques déjà traités 87/100 60 Cirrhotiques déjà traités 27/45 Zeuzem S, Allemagne, AASLD 2013, Abs. 1085, actualisé
- 63. Trithérapie courte Peg/RBV + sofosbuvir chez les génotypes 2 et 3 Résultats en intention de traiter (3 perdus de vus) 63 Pourcentage de réponse à S12 AASLD 2013 - D’après Lawitz E al., abstract LB4, actualisé 9/9 13/14 10/12 10/12 Absence de cirrhose Cirrhose
- 64. Antiviraux Hépatite B Interféron α Analogues de: Nucléosides Nucléotides Hépatite C Interféron α Autres interférons Ribavirine Anti-protéases Anti-polymérase: Nucléosidiques Non nucléosidiques Inhibiteurs d’entrée Agonistes Toll-like récepteurs
Notes de l'éditeur
- L’étude de Lau a montré que chez les patients Ag HBe + un traitement par Pegasys permettait une séroconversion HBe chez 32 % des patients (87/271) et une séroconversion HBs chez 3 % des patients (8/271). Cette étude a pour but d’étudier la cinétique de l’ADN du VHB sous traitement en fonction de la réponse. Elle montre que cette séroconversion survient chez 33 % des patients dans les 24 premières semaines de traitement, chez 29 % entre la semaine 24 et 48 et chez 38 % des patients dans les 6 mois qui suivent l’arrêt du traitement. L’ADN du VHB baisse significativement plus rapidement et de façon plus importante chez les patients ayant une séroconversion HBe et HBs.
- L’association sofosbuvir plus daclatasvir pendant 24 semaines est actuellement un des traitements recommandés en Europe dans le traitement des génotypes 3 avec l’association sofosbuvir et ribavirine pendant 24 semaines et la trithérapie de 12 semaines sofosbuvir + PR. Cette recommandation pour l’association sofosbuvir plus daclatasvir est basée sur une étude qui ne porte que sur des patients naïfs traités pendant 24 semaines (Sulkowski M et al. N Engl J Med 2014). L’objectif de cette étude de phase 3 est de tester cette association sur une période plus courte de 12 semaines sans ribavirine. 152 patients ont été inclus, 101 patients naifs de traitement dont 19 patients avec cirrhose et 51 patients en échec de traitement dont 13 patients avec cirrhose. Parmi les patients en échec, 61 % étaient rechuteurs à une bithérapie 14 % non répondeurs nuls, 4 % répondeurs partiels et 22 % intolérants ou échappeurs à une bithérapie. Les patients ont été traités 12 semaines avec 400 mg/j de sofosbuvir plus 60 mg/j de daclatasvir. La RVS 12 est définie par un ARN VHC < 25 UI/ml par le test TaqMan Roche. Le statut de cirrhose n’a pu être déterminé que chez 141/152 patients. Chez 11 patients il existait une discordance entre un fibrotest entre 0,48 et 0,75 ou un APRI > 1 et < 2 . La tolérance est bonne avec un patient ayant un EIG, 20 % des patients ont eu des céphalées et 19 % une fatigue d’intensité modérée. Sur le plan biologique pas d’effet secondaire notable. La RVS chez les patients sans cirrhose est comprise entre 94 % chez les patients en échec à 97 % chez les patients naïfs. Par contre, chez les patients cirrhotiques la RVS est moins bonne 58 % chez les patients naïfs et 69 % chez les patients en échec de bithérapie. Un patient était toujours détectable à S12 et 16 patients ont eu une rechute dont une tardive entre S4 et S12 et 9/16 avaient une mutation de la région NS5A Y93H au moment de la rechute. Le traitement idéal des patients cirrhotiques de génotype 3 reste pour l’intant à déterminer : 24 semaines ? avec ribavirine ? ou avec d’autres molécules type inhibiteur de la cyclophiline ?.
- Il s’agit d’une étude indépendante du NIH. 21 patients (âge médian 55 ans, 67 % hommes, 43 % de race noire, 29 % d’origine égyptienne, 24 % d’américains, 10 % F3 et 33 % F4, 38 % prétraités) ont été traités par LDV/SOF pendant 12 semaines. La RVS était de 95 %. Le stade de fibrose et la non-réponse n’influençaient pas la RVS dans cette étude pilote. Le traitement était bien toléré.
- Les patients de génotype 3 sans cirrhose ont une excellente réponse.
- Les patients de génotype 3 avec cirrhose ont aussi une excellente réponse à 100 mg de GS-5816. C’est la première fois que l’on atteint ce niveau de RVS chez des patients de génotype 3 cirrhotiques en échec d’interféron pegylée et ribavirine.
- Diapositive récapitulative de la RVS12 chez les malades de génotype 2 ou 3 traités par SOF + RBV pendant 12 ou 16 semaines ou PEG-IFNα-2a + RBV pendant 24 semaines. La RVS12 est donnée pour la population globale, en fonction du génotype et chez les malades cirrhotiques.
- Les taux de réponse étaient excellents, supérieurs à 90 % chez les génotypes 2. Chez les génotypes 3 le taux de RVS était de 83 % et n’était pas modifié par la présence d’une cirrhose. Il faut de plus noter qu’il s’agit de résultats en intention de traiter et que sur les 4 échecs observés 2 étaient dus à des malades perdus de vue. Bien que les effectifs soient faibles, ces résultats suggèrent qu’une trithérapie courte de 12 semaines avec interféron entraine des résultats pour le génotype 3 similaires à ceux observés dans le génotype 1. Il parait donc s’agir d’une option thérapeutique raisonnable pour le génotype 3, peut-être plus efficace qu’une bithérapie sofosbuvir + ribavirine de 24 semaines même si des études comparatives sont nécessaires pour tirer conclusion.