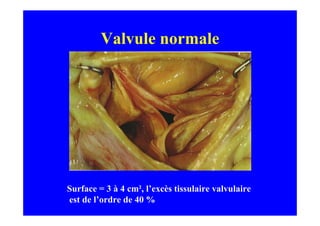
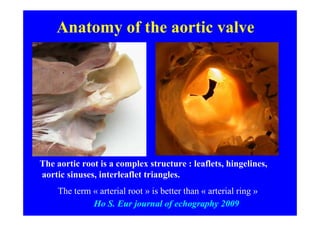
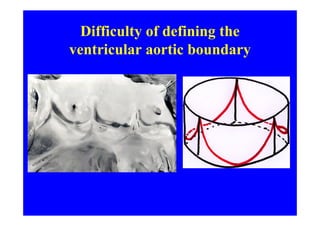
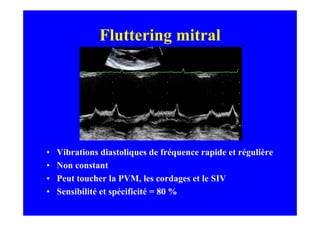
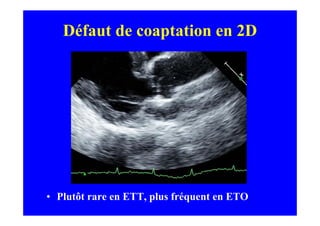
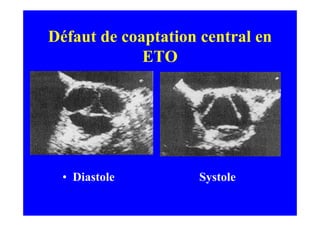
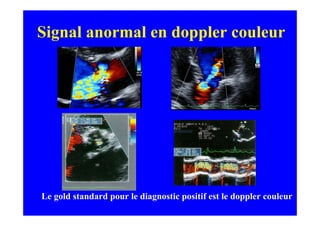
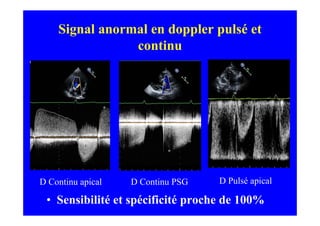
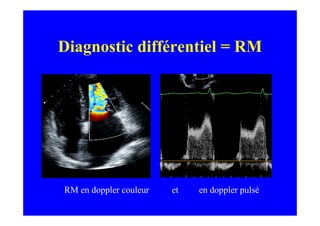
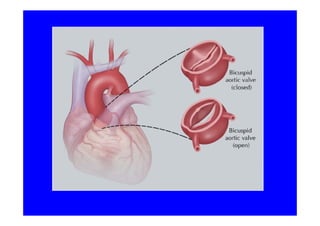
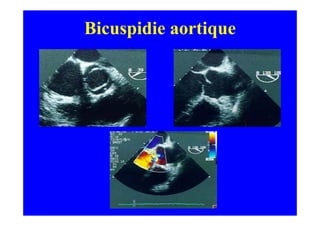
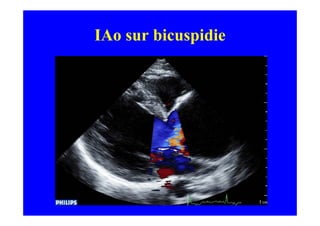
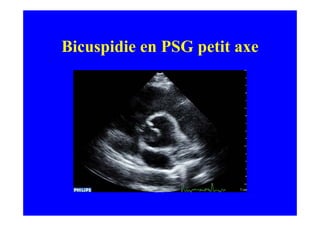
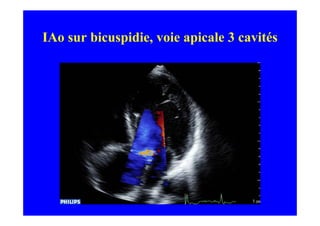
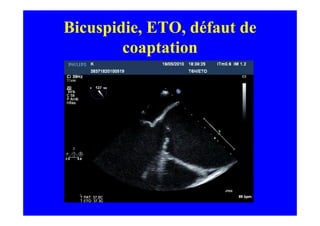
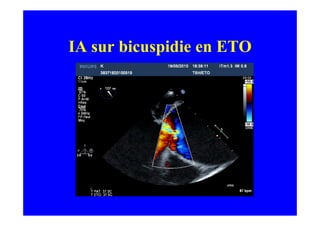
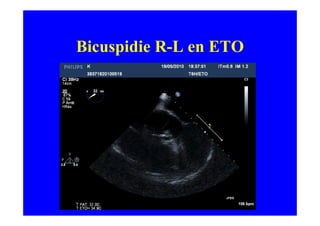
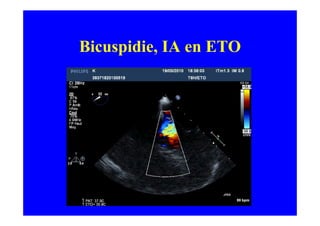
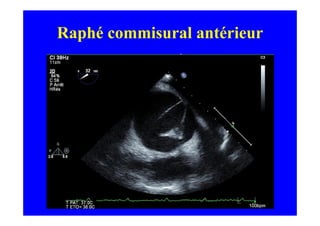
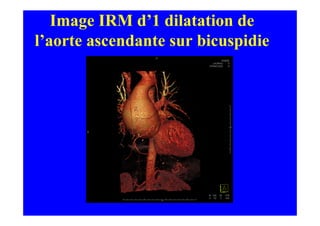
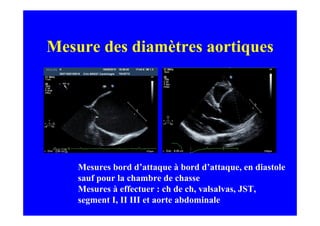
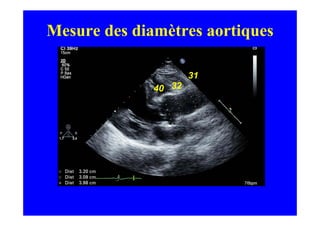
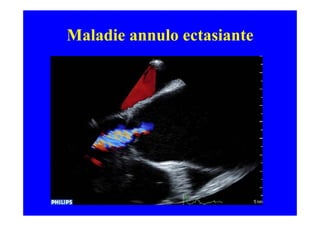
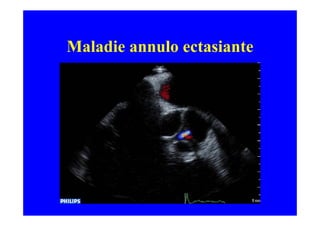
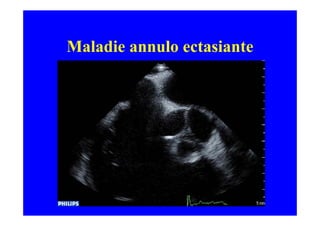
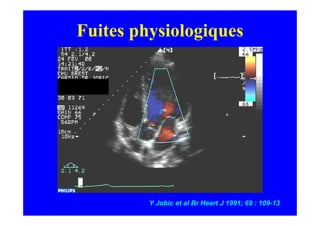
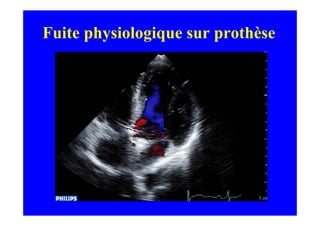
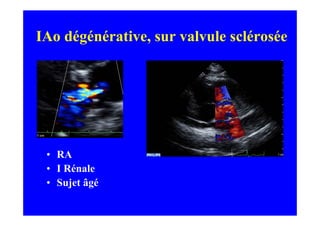
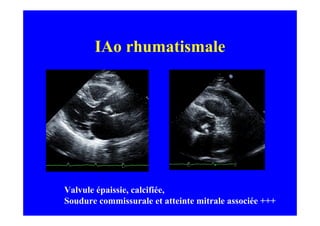
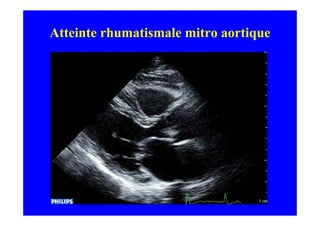
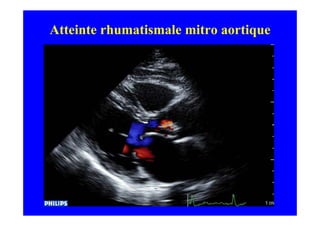
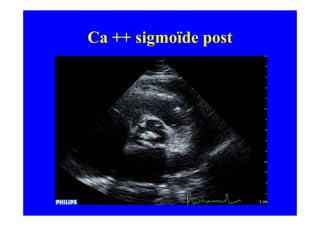
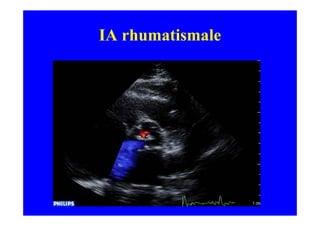
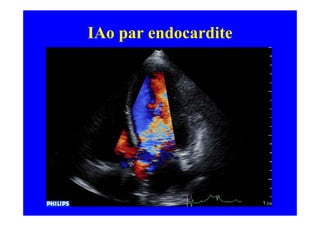
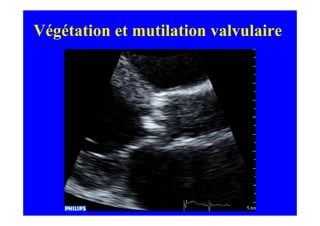
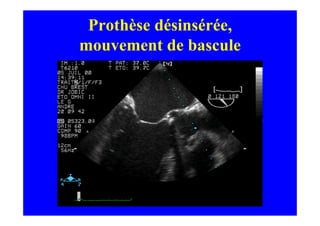
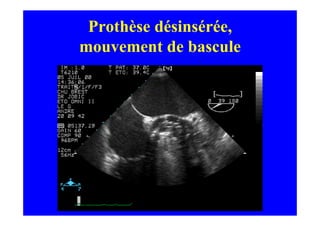
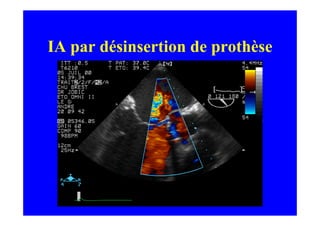
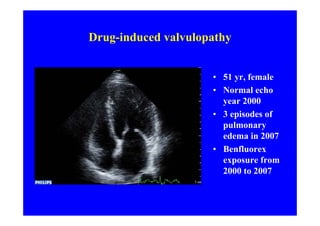
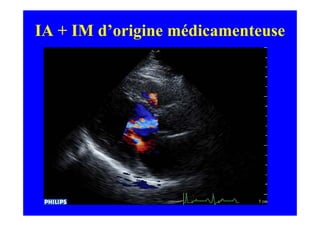
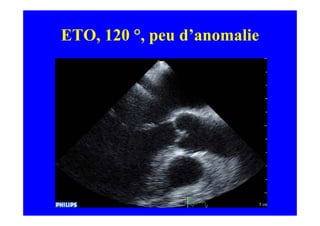
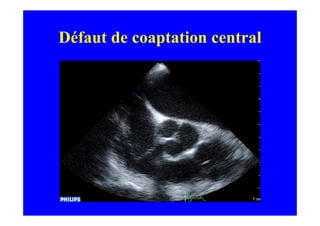
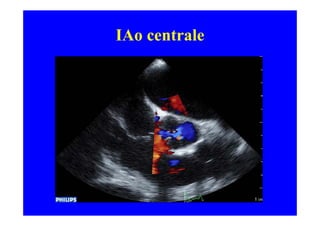
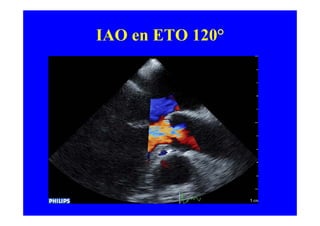
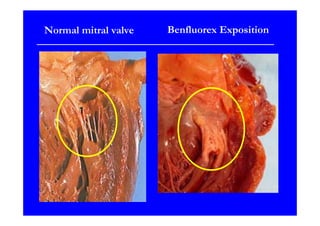
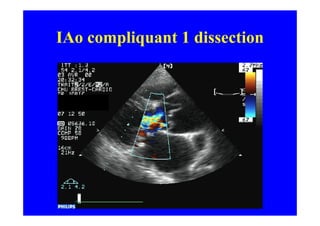
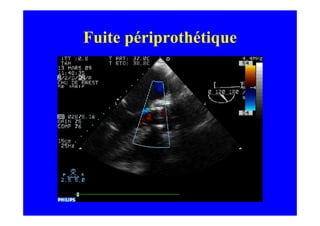
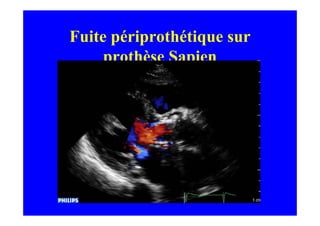
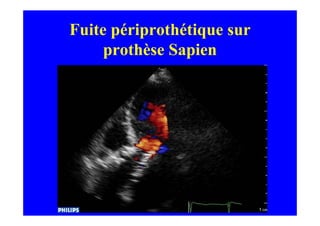
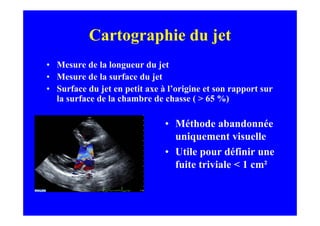
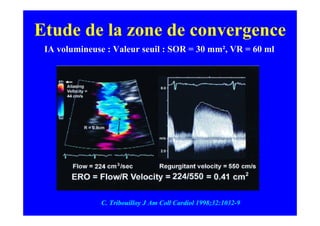
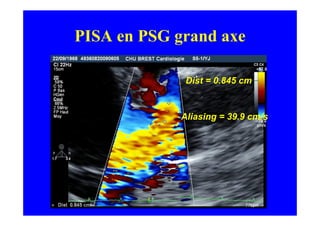
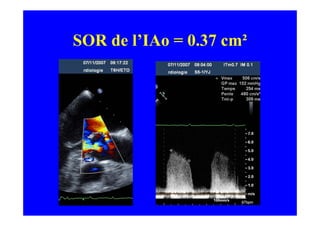
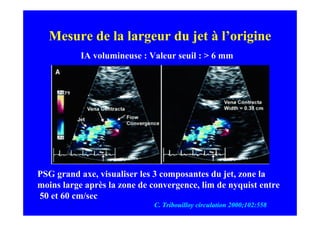
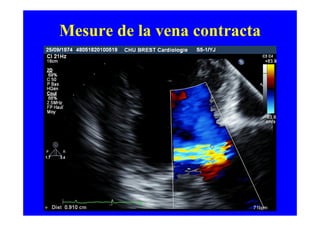
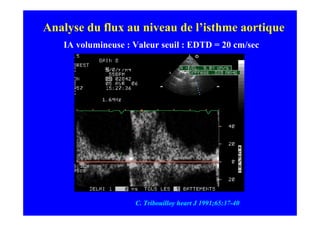
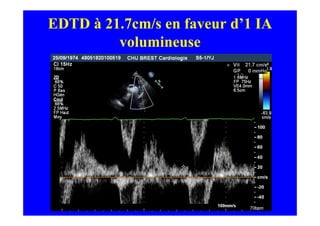
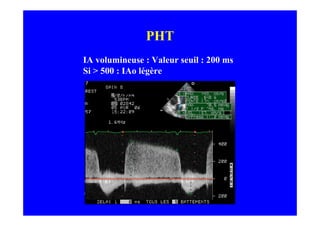
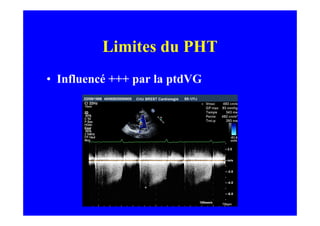
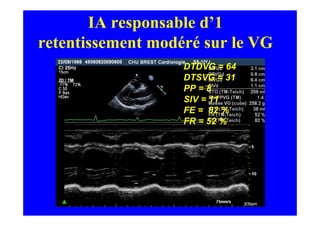
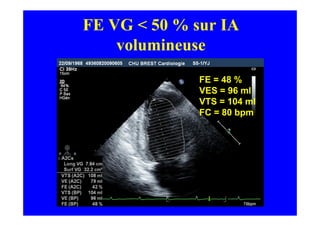
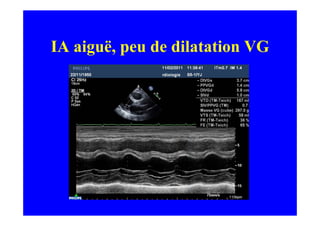
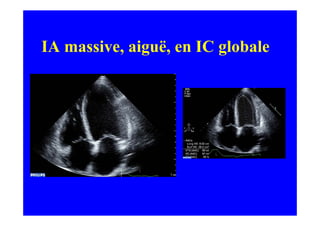
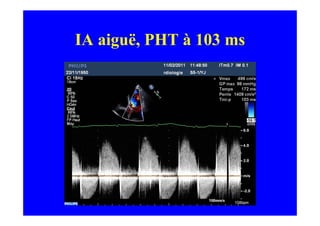
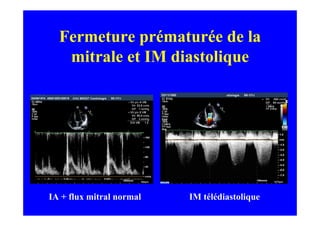
L'écho Doppler est essentiel pour évaluer les fuites aortiques, permettant diagnostic, étiologie et gestion. Différents mécanismes de régurgitation aortique incluent la bicuspidie et la dilatation aortique, avec des critères précis pour l'indication opératoire et le suivi des patients. Des techniques de quantification comme la méthode PISA et l'analyse des jets Doppler sont cruciales pour évaluer le retentissement sur le ventricule gauche.